電池の仕組み
ボルタ電池
- プラス電極(銅)
- マイナス電極(亜鉛)
- 電解液(希硫酸)
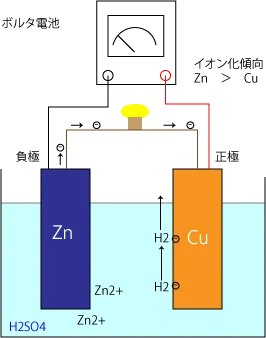
負極 : Zn → Zn2+ + 2e-
正極 : CuO + 2H+ + 2e-→ Cu + H2O
イオン化傾向の高い亜鉛が溶け出して、亜鉛イオンとなり、水素イオンが電子を受け取り水素ガスが発生する。
しかし、水素ガスが発生した後は正極を絶縁性の水素ガスが覆ってしまい、新たな水素イオンが近づけなくなるので、起電力は1.1V→0.76Vへと低下する。この状態を分極という。
マンガン電池
- プラス電極(二酸化マンガン→集電棒として炭素棒)
- マイナス電極(亜鉛容器)
- 電解液(塩化亜鉛)
ここでの炭素は黒鉛(グラファイト)であり、炭素原子の4本の手のうち3本は共有結合に使われるものの残り1本は炭素原子全体で1つの電子を共有している。
この自由電子が黒鉛内を自由に移動できるので、黒鉛は導電体。
電解液は液体ではなく、二酸化マンガンと混合されてペースト状にして充填される。そのため、乾電池と呼ばれる。
休み休み使うことでパワーが回復するので小電力を必要とする機器に向く。
そのパワーのランクが、緑色(標準)、青色(高容量)、赤色(高出力)、黒色(高性能)の順に上がるが全て1.5Vである。電圧が同じなため、ここでのパワーは、電池の容量と同義である。
反応式は、
8MnO2+8H2O+ZnCl2+4Zn → 8MnOOH+ZnCl2・4Zn(OH)2
亜鉛電極(負極)では、Zn→Zn2++2e-の反応が起こり、
炭素棒(正極)では、電子を受け取りマイナスに帯電する。すると塩化亜鉛のZn2+が集まってきて電子を受け取ってZnとなるが、
2Zn+2H2O → 2Zn-+2OH-+H2が起こり、発生した絶縁性の水素ガスは酸化剤である二酸化マンガンと反応して、オキシ水酸化マンガン(III)となる。
2MnO2+H2 → 2Mn(O)OH
アルカリマンガン電池
- プラス電極(二酸化マンガン→集電棒としてメッキ処理された真鍮棒)
- マイナス電極(亜鉛)
- 電解液(水酸化カリウム)
通常は短縮形のアルカリ電池で呼ばれる。
マンガン電池に比べてハイパワーであると表現されるが、実際は電池の持ちが2~5倍であるだけで、電圧は同じ1.5Vである。
容量が多いほうが結果的に大電流を長時間流すことが可能となるため、大きな電流を使用する機器に向いているともいえる。
反応式は、
MnO2+H2O+Zn → Mn(OH)2+ZnO
マンガンとアルカリの比較
どちらであっても液漏れをする可能性はあり、液漏れした場合は強アルカリのアルカリ電池よりもマンガン電池のほうが被害が少なく済むため、長期間入れっぱなしにする機器にはマンガン電池が一般的には推奨されている。
液漏れの10年保証をつけているアルカリ電池は、マクセルのボルテージと富士通のPremiumTypeだけなようです。
また、液漏れを含めた性能比較については下記サイト参照。
- パナソニックの乾電池で、10年間液漏れや放電(yahoo知恵袋)
- マンガン、アルカリ電池比較
標準電極電位
標準電極電位は金属であれば存在し、単位はε。
水素イオンが電子を受け取った時の電位を0Vとして、各金属が電子を受け取ったときの電位を示したものであり、受け取りやすいのは銅などのイオン化傾向が低い金属なのでこれらがプラスに、電子を受け取りにくいイオン化傾向が高い亜鉛などの金属はマイナスとなる。
(K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>H>Cu>Hg>Ag>Pt>Au)の水素を境に起電力のプラスとマイナスが変わる)
電位の大きいほうがカソード、小さいほうはアノードという。
カソード+では電子を受け取る還元反応:
- 2H++2e- → H2・・・ 0V
- Cu2++2e- → Cu・・・+0.34V
アノード-では電子を与える酸化反応:
- Zn → Zn2++2e-・・・+0.76V
等が起こる。
酸化力が高い=自分が還元されやすい=電子を受け取りやすい=イオンになりにくい金属ほど標準電極電位は高い
そして、この標準電極電位の差が電位差となるため、亜鉛と銅を使うボルタ電池の起電力は0.34+0.76=1.1Vとなる。(実際には分極により、銅は水素ガスで覆われるので0.76Vとなる)

