パーキンソン病のメカニズム
パーキンソン病はいまだ発症の原因は不明(細胞内のミトコンドリア障害や酸化ストレス等の可能性が示唆)であるが、メカニズムに関しては明らかにされている。
中脳の黒質で作られたドパミンが黒質神経細胞終末のシナプス小胞からシナプス間隙へと放出され、大脳基底核の線条体の神経細胞とシナプスを形成し、線条体のレセプターへ取り込まれる。
一部のドパミンは黒質神経終末へDAT(ドパミントランスポーター)を介して再取り込みされてドパミン量調節へと使われる。
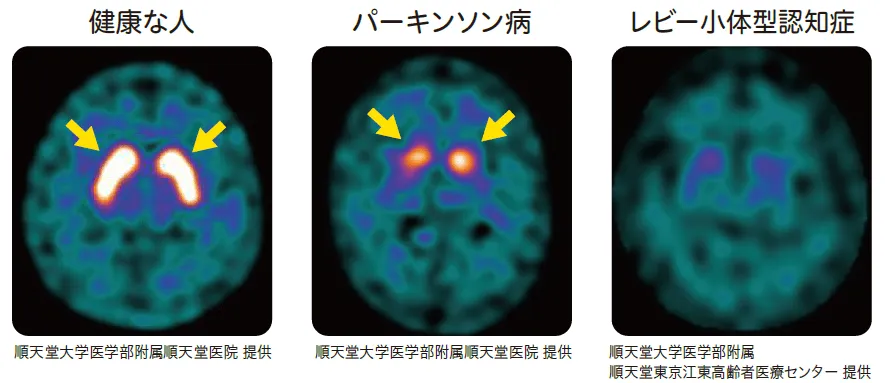
DATスペクト検査(ドーパミントランスポーターシンチグラフィー)では、ドパミン神経の障害を画像で捉えることができる。DATスペクト検査では特定の放射性トレーサー(例えば、[^123I]FP-CIT)を使用して、ドーパミントランスポーター(DAT)の分布と濃度を測定し、ドーパミンの再取り込みと代謝の過程を観察できます。
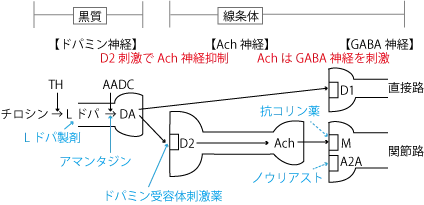
このメカニズムを考えるのにはAch(アセチルコリン)とDA(ドパミン)の天秤の関係を理解することが大切で、Achが多くなるとDA量は減り、逆にDA量が多くなるとAchが増えるというように、お互いが競合関係にあるといえる。
ドパミンはチロシンからTH(チロシン水酸化酵素)の働きでLドパになり、L-ドパ(レボドパ)をドパミンに変換するためには、アミノ酸脱炭酸酵素(AADC)が必要です。AADCは、レボドパをドパミンに変換する鍵となる酵素で、この反応は中枢神経系および末梢神経系の両方で起こる。
ドパミン自体はBBB(血液脳関門)を通過できないため、パーキンソン病の治療においてはBBBを通過できるレボドパを使用する。
しかし、レボドパは末梢でもAADCによってドパミンに変換されるため、時に末梢での副作用を引き起こすことがある。このため、レボドパ療法では通常、カルビドパやベンセラジドのような末梢のドパミン脱炭酸酵素阻害剤と併用される。これらの薬剤は血液脳関門を通過せず、末梢でのレボドパのドパミンへの変換を防ぎ、副作用を減少させるのに役立つ。
すくみ足抑制の機序は以下の通りで、青斑核のドパミン不足、またはDBH(ドパミンβヒドロキシラーゼ)の活性低下によりノルアドレナリンが作られないことによる。
ノルアドレナリンの前駆物質であるドロキシドパをすくみ足の抑制のために使う。
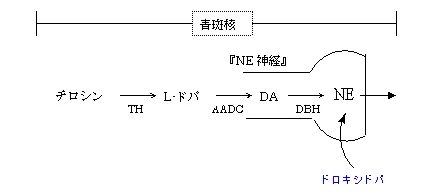
パーキンソン病ではTH(チロシン水酸化酵素)やDBH(ドーパミンβ-ヒドロキシラーゼ)の活性低下(交感神経の低下)が見られる。
MIBG心筋シンチグラフィーは、MIBG(メタヨジンベンジルグアニジン)という放射性トレーサーを用い、心臓の交感神経系の機能を調べることができ、心臓病や神経系の疾患(パーキンソン病、レビー小体型認知症、多系統萎縮症等の交感神経系に影響を及ぼすもの)、褐色細胞腫の鑑別診断に用いられる。
パーキンソン病でのMRIはパーキンソン病以外の疾患を除外するために用いる(パーキンソン病自体は鑑別できない)
関連ページ
- パーキンソン病の薬一覧
- パーキンソン病について
- ヘーンとレーン分類
- パーキンソン病の原因と症状
- パーキンソン病の治療法・・・WearingOff、ジスキネジアの対処法
- レストレスレッグス症候群
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


