目次
後発医薬品への変更について
注意喚起:グラセプターとタクロリムス普通製剤(後発医薬品含む)との取り違え注意のお願い(2023.11.1)
現下の医療用医薬品の供給状況における変更調剤の取扱いについて
1 後発医薬品の銘柄処方において、「変更不可」欄に「レ」又は「×」が記載されていない場合にあっては、患者に対して調剤する薬剤を変更することを説明の上、同意を得ることで、当該処方薬に代えて、先発医薬品(含量規格が異なるもの又は類似する別剤形のものを含む。)を調剤することができる。
2 処方薬の変更調剤を行うに当たって、以下に掲げるものについては、変更調剤後の薬剤料が変更前のものを超える場合であっても、患者に対してその旨を説明の上、同意を得ることで、当該変更調剤を行うことができる(ただし、規格又は剤形の違いにより効能・効果や用法・用量が異なるものを除く。)。
- ① 含量規格が異なる後発医薬品又は類似する別剤形の後発医薬品への変更調剤
- ② 内服薬のうち、類似する別剤形の後発医薬品への変更調剤がやむを得ずできない場合であって、次に掲げる分類間の別剤形(含量規格が異なる場合を含む。)の医薬品への変更調剤
- ア 錠剤(普通錠)、錠剤(口腔内崩壊錠)、カプセル剤、丸剤
- イ 散剤、顆粒剤、細粒剤、末剤、ドライシロップ剤(内服用固形剤として調剤する場合に限る。)
(例:アに該当する錠剤をイに該当する散剤への変更調剤)
3 保険薬局において、上記1又は2の対応を行った場合には、調剤した薬剤の銘柄(含量規格が異なる後発医薬品を調剤した場合にあっては含量規格を、処方薬とは別の剤形の後発医薬品を調剤した場合にあっては剤形を含む。)等について、当該調剤に係る処方箋を発行した保険医療機関に情報提供すること。ただし、当該保険医療機関との間で、調剤した薬剤の銘柄等に係る情報提供の要否、方法、頻度等に関してあらかじめ合意が得られている場合は、当該合意に基づいた方法等により情報提供を行うことで差し支えない。
処方箋に記載された医薬品の後発医薬品への変更について
第1 銘柄名処方に係る処方薬の保険薬局における調剤の方法について
1 処方薬(銘柄名処方に係るものに限る。)の「変更不可」欄に「レ点」又は「×」が記載されていない場合、処方薬に代えて、後発医薬品(含量規格が異なるもの又は類似する別剤形のものを含む。)を調剤することができる。
ただし、処方薬の近傍に「含量規格変更不可」又は「剤形変更不可」の記載等がある場合には、患者に対して説明し同意を得ることを条件に、従来からの取扱いどおり、その指示に従い調剤することができる。
2 処方薬(銘柄名処方に係るものに限る。)の「変更不可」欄に「レ点」又は「×」の記載があり、かつ、「保険医署名」欄に処方医の署名又は記名・押印がある場合処方薬を後発医薬品(含量規格が異なるもの及び類似する別剤形のものを含む。)には変更できない。
注1:規格の違いにより効能・効果や用法・用量が異なる品目については、対象外とする。
注2:含量規格の変更とは、例えば、処方箋に記載された先発医薬品の10mg錠1錠に代えて後発医薬品の5mg2錠を調剤すること。
注3:銘柄名処方でもレ点や×が記載されていなければ、後発品に変更できるということ
第2 一般名処方に係る処方薬の保険薬局における調剤の方法について
処方薬と一般的名称が同一である成分を含有する医薬品(含量規格が異なる後発医薬品又は類似する別剤形の後発医薬品を含む。)を調剤することができる。
ただし、処方薬の近傍に「含量規格変更不可」又は「剤形変更不可」の記載等がある場合には、患者に対して説明し同意を得ることを条件に、従来からの取扱いどおり、その指示に従い調剤することができる。
第3 変更調剤を行う際の留意点について
1 一般名処方とは、単に医師が先発医薬品か後発医薬品かといった個別の銘柄にこだわらずに処方を行っているものであること。
2 先発医薬品から後発医薬品への変更調剤が可能な処方箋又は一般名処方に係る処方箋を受け付けた保険薬局の保険薬剤師は、1も踏まえつつ、患者に対して後発医薬品に関する説明を適切に行うとともに、後発医薬品を調剤するよう努めなければならないものであること。
3 処方薬から後発医薬品(含量規格が異なるものを含む。)への変更調剤(類似する別剤形の後発医薬品への変更調剤を除く。)は、処方薬と同一の剤形の後発医薬品が対象となるものであること。
4 含量規格が異なる後発医薬品又は類似する別剤形の後発医薬品への変更調剤は、変更調剤後の薬剤料が変更前のものと比較して同額以下であるものに限り、対象となるものであること。また、含量規格が異なる後発医薬品又は類似する別剤形の後発医薬品への変更調剤は、規格又は剤形の違いにより効能・効果や用法・用量が異なる場合には対象外とするものであること。
5 類似する別剤形の医薬品とは、内服薬であって、次の各号に掲げる分類の範囲内の他の医薬品をいうものであること。(※ゼリーやシャンプーはその剤形のみでの変更)
- ア 錠剤(普通錠)、錠剤(口腔内崩壊錠)、カプセル剤、丸剤
- イ 散剤、顆粒剤、細粒剤、末剤、ドライシロップ剤(内服用固形剤として調剤する場合に限る。)
- ウ 液剤、シロップ剤、ドライシロップ剤(内服用液剤として調剤する場合に限る。)
なお、外用薬は、処方医への確認を要しない変更調剤の対象外とする。
6 後発医薬品への変更調剤を行うに当たり、保険薬局の保険薬剤師は、当該保険薬局において当該後発医薬品を選択した基準(例えば、当該後発医薬品に係る薬価、製造販売業者における製造、供給、情報提供に係る体制及び品質に関する情報開示の状況等)を患者に対して説明すること。
7 保険薬局において、銘柄名処方に係る処方薬について後発医薬品(含量規格が異なるもの及び類似する別剤形のものを含む。)への変更調剤を行ったとき又は一般名処方に係る処方薬について調剤を行ったときは、調剤した薬剤の銘柄(含量規格が異なる後発医薬品を調剤した場合にあっては含量規格を、類似する別剤形の後発医薬品を調剤した場合にあっては剤形を含む。)等について、当該調剤に係る処方箋を発行した保険医療機関に情報提供すること。
ただし、当該保険医療機関との間で、調剤した薬剤の銘柄等に係る情報提供の要否、方法、頻度等に関してあらかじめ合意が得られている場合は、当該合意に基づいた方法等により情報提供を行うことで差し支えない。
第4 その他
処方箋における変更調剤に関する記載方法については、「診療報酬請求書等の記載要領等について」(昭和51年8月7日保険発第82号)別紙2の第5「処方箋の記載上の注意事項」によるものであること。
補足(調剤報酬点数表に関する事項)
区分10の3 服薬管理指導料
2 服薬管理指導料「1」及び「2」
(3) 患者への薬剤の服用等に関する必要な指導
- イ 以下の事項については、処方箋の受付後、薬を取りそろえる前に、保険薬剤師が患者等に確認すること。
- (イ) 患者の体質(アレルギー歴、副作用歴等を含む)、薬学的管理に必要な患者の生活像及び後発医薬品の使用に関する患者の意向
カ 一般名処方が行われた医薬品について、原則として後発医薬品が使用されるよう、患者に対し後発医薬品の有効性、安全性や品質について懇切丁寧に説明をした場合であって、後発医薬品を調剤しなかった場合は、その理由を調剤報酬明細書の摘要欄に記載する。
補足(調剤報酬請求書・明細書)
(27) 「摘要」欄について
セ 一般名処方が行われた医薬品について後発医薬品を調剤しなかった場合は、その理由について、「患者の意向」、「保険薬局の備蓄」、「後発医薬品なし」又は「その他」から最も当てはまる理由をひとつ記載すること。
7 「処方」欄について
(5) 処方医が処方箋に記載した医薬品の一部又はすべてについて後発医薬品への変更に差し支えがあると判断したときには、「備考」欄中の「保険医署名」欄に署名等を行うとともに、差し支えがあると判断した医薬品ごとに「変更不可」欄に「レ」又は「×」を記載し、患者及び処方箋に基づき調剤を行う保険薬局の保険薬剤師のいずれに対しても変更不可であることが明確に分かるように記載すること。なお、一般名処方の趣旨からして、一般名処方に対して「変更不可」欄に「レ」又は「×」が記載されることはあり得ないものであること。
(6) 処方医が処方箋に記載した医薬品のうち(5)に基づいて「変更不可」欄に「レ」又は「×」を記載していないもののうち、当該医薬品と含量規格が異なる後発医薬品又は類似する別剤形の後発医薬品への変更に差し支えがあると判断したときには、「備考」欄中の「保険医署名」欄に署名等を行うとともに、当該医薬品の銘柄名の近傍に「含量規格変更不可」又は「剤形変更不可」と記載するなど、患者及び処方箋に基づき調剤を行う保険薬局の保険薬剤師のいずれに対しても含量規格変更不可又は剤形変更不可であることが明確に分かるように記載すること。
8 「備考」欄について
(5) 処方医が、処方箋に記載した医薬品について後発医薬品に変更することに差し支えがあると判断した場合は、差し支えがあると判断した医薬品ごとに、「処方」欄中の「変更不可」欄に「レ」又は「×」を記載するとともに、「保険医署名」欄に署名又は記名・押印すること。
なお、後発医薬品を処方する際に、「変更不可」欄に「レ」又は「×」を記載する場合においては、その理由を記載すること。
別表Ⅰ 調剤報酬明細書の「摘要」欄への記載事項等一覧
(長期収載品について、選定療養の対象とはせずに、保険給付する場合)
理由のうち、該当するものを記載すること。
- ①医療上の必要があると医師又は歯科医師が判断したため
- 長期収載品と後発医薬品で薬事上承認された効能・効果に差異がある場合であって、当該患者の疾病に対する治療において長期収載品を処方等する医療上の必要があると医師又は歯科医師が判断する場合。
- 当該患者が後発医薬品を使用した際に、副作用や、他の医薬品との飲み合わせによる相互作用、先発医薬品との間で治療効果に差異があったと医師又は歯科医師が判断する場合であって、安全性の観点等から長期収載品の処方等をする医療上の必要があると判断する場合。
- 学会が作成しているガイドラインにおいて、長期収載品を使用している患者について後発医薬品へ切り替えないことが推奨されており、それを踏まえ、医師又は歯科医師が長期収載品を処方等する医療上の必要があると判断する場合。
- 後発品の剤形では飲みにくい、吸湿性により一包化ができないなど、 剤形上の違いにより、長期収載品を処方等する医療上の必要があると判断する場合。
- ②後発品の剤形では飲みにくい、吸湿性により一包化ができないなど、 剤形上の違いにより、長期収載品を調剤する必要があると薬剤師が判断する場合。ただし、単に剤形の好みによって長期収載品を選択することは含まれない。
- ③後発医薬品の在庫状況等を踏まえ後発医薬品を提供することが困難な場合。
※記載は制度が施行となる令和6年10月からとする
- 820101325 医療上の必要性があると医師又は歯科医師が判断したため(処方箋の「変更不可(医療上必要)」欄に「レ」又は「×」の記載があった場合等)
- 820101326 剤形上の違いにより、長期収載品を調剤する必要があると薬剤師が判断したため
- 820101324 後発医薬品の在庫状況等を踏まえ後発医薬品を提供することが困難なため
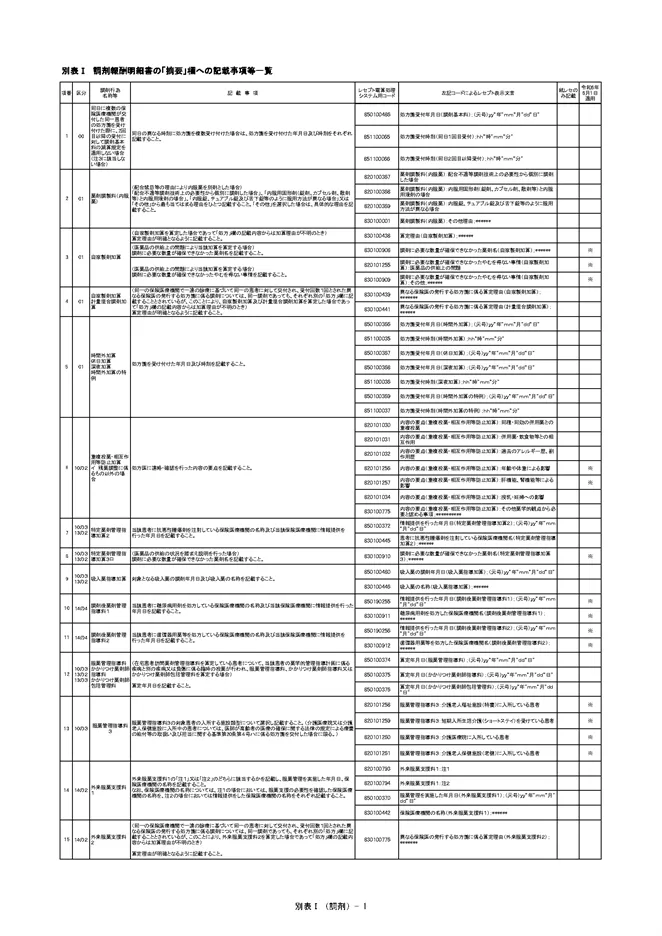
- 一枚の処方箋に、一般名処方されているのにもかかわらず、後発医薬品に変更しない医薬品が複数あり、かつ、理由も複数ある場合、レセプトの記載する理由は、最も当てはまる理由を書くことで足りる。医薬品ごとに異なる理由があった場合でも、医薬品ごとに記載するのではなく、一つだけ選んで記載する。(H26保険調剤Q&A Q193)
補足(その他)
- 後発品から後発品への変更調剤は、H18年の疑義解釈で、「特定の後発医薬品の銘柄を処方し、処方箋に後発医薬品への変更可の欄に署名等を行った場合でも、患者の求めがあった場合等については、保険薬局において、患者が他の後発医薬品を選択することは可能」との記載があるが、その後にレ点の文言が追加されたりで、効力があるかどうかは不明。変更後の情報提供をしなければならないことから一般的には変更していないのが現状。
- 新たに追加された文(同額またはそれ以下で、患者の同意があった場合)は、含量規格が異なる後発医薬品又は類似する別剤形の後発医薬品への変更調剤に関するものであるので、患者の同意があれば、値段の安い後発医薬品から値段の高い後発医薬品への変更は可能であるように思われます。
- 後発医薬品に変更可能な処方箋で、記載されている先発医薬品を後発医薬品に変更した場合は、調剤した後発医薬品の銘柄情報等を処方医へ情報提供するが、一般名処方の場合にも調剤した医薬品が先発医薬品か後発医薬品かにかかわらず情報提供が必要となる。(H26保険調剤Q&A Q184)
- 類似する別剤形の後発医薬品への変更調剤については、内服薬に限り認められているが、含量規格が異なる後発医薬品への変更については、外用薬についても認められている。(同Q&A Q187)
例)モーラステープL40→ケトプロフェンテープ20×2P、HT2㎎→ツロブテロールテープ1㎎×2枚、シムビコート60→ブデホル30×2個、モメタゾン点鼻112噴霧→モメタゾン点鼻56噴霧×2本等。
用法(1回○滴、○吸入等)も変更しなければならないものはおそらく不可(クラビット点眼1.5%→レボフロキサシン点眼0.5%3本等) - 外用薬については剤形変更(例:ヒルドイドソフト100g→ヒルドイドクリーム/ヒルドイドフォーム/ヒルドイドゲル100gへの変更)は認められていない。
- ヒルドイドフォーム92gの処方はヘパリン類似物質外用スプレー100gもしくは泡状スプレー100gに変更可能(マルホ確認済)。
それであれば、【般】ヘパリン類似物質スプレー0.3% 100gの処方も【般】ヘパリン類似物質スプレー0.3% 92gも、フォーム92gとスプレー100gどちらを出してもよいことになるが、マルホ曰く、【般】ヘパリン類似物質スプレー0.3% 92gはヒルドイドフォーム92gしか調剤できず選定療養対象外、【般】ヘパリン類似物質スプレー0.3% 100gは先発、後発ともに調剤可能で選定対象とのこと。
(※この情報はXの北の薬屋さんとぐで太郎さんのポストをもとに記載しています。) - R7.8.14より、
- 【般】ヘパリン類似物質外用液0.3%(乳剤性)・・・ヒルドイドLo、ラクール、NIT以外は疑義紹介
- 【般】ヘパリン類似物質外用液0.3%(水性)・・・日医工、ニプロ、ニットー、YD以外は疑義紹介

- 後発医薬品への変更可能な処方箋に基づき、後発医薬品に変更調剤した場合や、一般名処方で後発医薬品に変更調剤した場合に、その内容を処方欄または備考欄に記載する必要はない。ただし、実際に調剤した医薬品名を、調剤録に記入すること。(同Q&A Q191)
- 先発医薬品から薬価の高い後発医薬品への変更は含量規格の変更でなれけば可能です(サワイHPより)。(例:イソバイドシロップ70%分包30mlからイソソルビド内溶液70%分包30ml「CEO」への変更:下記コメントNo1930、マイザー軟膏からジフルプレドナート軟膏等):このケースにおいて、イソバイドやマイザーは先発品、イソソルビドやジフルプレドナートは後発品算定割合に含めない(先発より薬価の高い)後発品に分類されますが変更可能です。
- テオロングの100㎎/200mg錠とテオフィリン「サンド」の100㎎/200mgカプセルは後発品調剤体制加算対象外
- 後発医薬品への変更は基本的には有効成分の含有量を目安に行うため、リーバクト配合顆粒(4.15g/包)のジェネリックとしてアミノバクト配合顆粒(4.74g/包)が対応できる。しかし、リピディルとフェノフィブラートカプセルは含有量が異なっていてもジェネリックとしてみなされる。悩んだらメーカーに聞くのが確実という結論。
- 基礎的医薬品は、それらが基礎的医薬品に指定される以前に変更調剤が認められていたもの(「診療報酬における加算等の算定対象となる後発医薬品」等)については、従来と同様に変更調剤を行うことができます。(令和6年調剤報酬改定で、クラリスロマイシンやメイアクトの先発と後発、フロモックスの先発と後発等多数の抗生物質が基礎的医薬品に追加された。フロモックスやメイアクトは依然として先発のままなので計算式に含まれるが、セフカペンピボキシル等は後発品の名札が外れたため、計算式からは除外する点に注意する)
- 局方品や局方名処方の変更方法は、局方名と局方品のページを参照。
- エリスロシン錠200mgとエリスロマイシン錠200mg「サワイ」について。
- エリスロシン錠は先発でも後発でも基礎的医薬品でも局方品でもない珍しい未分類の医薬品。一般名はエリスロマイシンステアリン酸塩で、胃で難溶性で腸で溶けるプロドラッグ製剤。
- エリスロマイシン錠は基礎的リストに載っている(後発のように調剤できるが後発ではない)基礎的医薬品。一般名はエリスロマイシンで、腸溶錠のフィルムコーティング製剤。
- 流通上の問題で、複数の銘柄(後発品複数メーカーの混在/先発医薬品と後発医薬品の混在)を用いた調剤を行う必要性がある場合、患者の同意があれば保険調剤上は問題はない。入力は継続服用で入力し、摘要欄へのコメントは不要。(社保確認済)
| 変更前 ※1 |
変更後 ※1 |
レ点or×点 ※6 |
署名or押印 | 価格 | 判定 | 情報提供 |
|---|---|---|---|---|---|---|
| 一般名 | 後発品or先発品 | ○ | ○or× | - | ※2 | - |
| 一般名 | 後発品or先発品 | × | ○ | - | OK | 必要 |
| 一般名 | 先発品 | × | × | - | OK | 必要 |
| 一般名 | 先発品(剤形・含量変更) | × | × | - | NG | - |
| 一般名 | 後発品 | × | × | 患者の同意 | OK | 必要 |
| 一般名 | 後発品(剤形変更(内服のみ)) | × | × | 患者の同意 |
OK | 必要 |
| 一般名 | 後発品(含量変更(内服+外用) | × | × | 患者の同意 |
OK | 必要 |
| 銘柄名 | 後発品 | ○ | ○ | - | NG | - |
| 銘柄名 | 後発品 | × | ○ | 患者の同意 | OK | 必要 |
| 銘柄名 | 後発品 | ○ | × | - | ※3 | - |
| 銘柄名 (先発品) |
先発品(剤形・含量変更) | × | × | - | NG | - |
| 銘柄名 (先発品) |
後発品 | × | × | 患者の同意 |
OK※4 | 必要 |
| 銘柄名 (先発品) |
後発品(剤形変更(分類間も可)(内服のみ)) | × | × | 患者の同意 |
OK※5 | 必要 |
| 銘柄名 (先発品) |
後発品(含量変更(内服(分類間も可)+外用)) | × | × | 患者の同意 |
OK※5 | 必要 |
| 銘柄名 (後発品) |
後発品 | ○ | ○ | 処方箋に理由を記載 | NG | - |
| 銘柄名 (後発品) |
先発品 | × | × | 患者の同意(変更前の同額以上でも可) | OK※5 | 必要 |
| 銘柄名 (後発品) |
先発品(剤形変更(内服のみ(分類間も可)) | × | × | 患者の同意(変更前の同額以上でも可) | OK※5 | 必要 |
| 銘柄名 (後発品) |
先発品(含量変更(内服(分類間も可)+外用)) | × | × | 患者の同意(変更前の同額以上でも可) | OK※5 | 必要 |
| 銘柄名 (後発品) |
後発品 | × | × | 患者の同意 | OK | 必要 |
| 銘柄名 (後発品) |
後発品(剤形変更(内服のみ) | × | × | 患者の同意 |
OK※5 | 必要 |
| 銘柄名 (後発品) |
後発品(含量変更(内服+外用) | × | × | 患者の同意 |
OK※5 | 必要 |
- ※ 含量・剤形変更は、外用剤は疑義照会なしでは不可。処方薬の近傍に「含量規格変更不可」又は「剤形変更不可」の記載等がある場合も疑義照会なしでは不可。
- ※ その他の医薬品(漢方製剤、局方品)は、先発品と後発品の概念がないため、変更調剤の対象からは除外。(参考)
- ※1 ここで言う後発医薬品には基礎的医薬品(以前まで後発医薬品として指定されていたもの(基礎的リスト)のみで、先発医薬品である基礎的医薬品は除く)を含みます。すなわち、基礎的医薬品は先発か以前後発だったかで、先発品に含めるか後発品に含めるかが違ってくるということ。
- ※2 一般名処方の場合に、「変更不可(医療上必要)」欄及び「患者希望」欄のいずれにも、「レ」又は「×」はあり得ないものである。(長期収載品の処方等又は調剤について等)
- ※3 「 レ点 」又は「×」を記載した場合は、処方箋の右下備考欄に署名or押印をする必要が有るため、処方箋の不備。
- ※4 同額及び薬価が高い後発医薬品であっても可
- ※5 根拠はR6.3.15通知。基本的にはやむを得ない場合のみ。
また、ア内やイ内の変更だけでなく、アとイの間(分類間)の変更も可
(※ゼリーやシャンプー等、ア・イに該当していない場合は不可))
なお、分類間の変更は後発→先発でも可(R6.3.15通知の1と2同時適用は可)(下記コメント2739より)- ア 錠剤(普通錠)、錠剤(口腔内崩壊錠)、カプセル剤、丸剤
- イ 散剤、顆粒剤、細粒剤、末剤、ドライシロップ剤(内服用固形剤として調剤する場合に限る。)
- ※6 R6年調剤報酬改定にて処方箋様式が変更され、変更不可欄は、「変更不可(医療上必要)」欄と「患者希望」欄になった。「変更不可(医療上必要)」欄を今までの変更不可欄と同じように長期収載品以外を銘柄名処方する際にも使用可能。「患者希望」欄は長期収載品を銘柄処方する場合以外では使用しない。一般名処方の場合はレ点を付けること自体が不可。
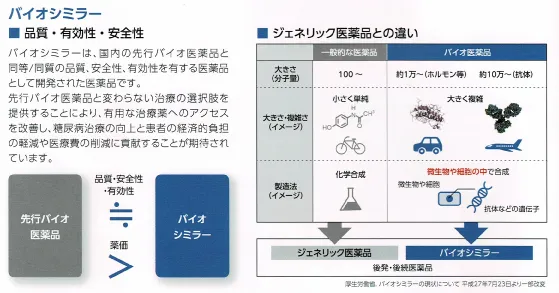
バイオ医薬品とバイオシミラー
バイオ医薬品は、遺伝子組み換えや細胞培養技術を使用して製造される医薬品のことで、バイオシミラーは国内ですでに承認されているバイオ医薬品(先行品)と同等/同質の品質、安全性及び有効性を有する医薬品として、特許期間が終了した後に、異なる製造業者から製造開発された医薬品。薬価は先行品の7割。(参考)
ここで言う同等/同質とは、先発医薬品に対する後発医薬品のような品質同一性の意味ではなく、類似性が高く、品質特性の差異を有していても、薬剤の安全性・有効性に影響しない薬剤で、剤形と投与経路のみ同一であれば問題ないという意味になる。
従来型ワクチン、ヘパリンなど多糖類、バイオシミラーに対するバイオシミラーは対象にならない。
つまり、後発医薬品とは異なるバイオシミラーとしての分類となるので、薬局で先発医薬品や後発医薬品からの変更はできない。
- ランタス注ソロスター → インスリングラルギンBS注ミリオペン「リリー」(変更不可)
- インスリングラルギンBS注ミリオペン「リリー」 → インスリングラルギンBS注キット「FFP」(変更不可)
Q&A(群馬県 社会保険委員会Q&Aより)
A:情報を提供しなければならない。
この背景には、薬局で先発医薬品を調剤することで、医科の「処方箋料」が減点される事例があるとのこと。(医科の「処方箋料」7種類以上投薬40点、それ以外68点、また、所定単位あたりの薬価が205円以下の場合は何銘柄あっても1種類とカウントのルールがある)
(2)また、基剤が異なる後発品医薬品への変更の場合(軟膏からクリーム)はどうか?
A:(1)厚労省のホームページに掲載されている「使用薬剤の薬価(薬価基準)に収載されている医薬品について」に掲載されている外用薬であれば、可能です。
(2)外用薬の基剤が異なる場合は不可です。
A:問題ないと思われる。
Q&A(H28年調剤報酬改定)
(答)基礎的医薬品であって、平成28年3月31日まで変更調剤が認められていたもの(「診療報酬における加算等の算定対象となる後発医薬品」等)については、従来と同様に変更調剤を行うことができる。
なお、その際にも「処方箋に記載された医薬品の後発医薬品への変更について」(平成24年3月5日付け保医発0305第12号)に引き続き留意すること。
Q&A(H24年調剤報酬改定)
(答) 含量規格が異なる医薬品または類似する別剤形の医薬品への変更については、後発医薬品へ変更調剤する場合に限り認められる。変更調剤は、後発医薬品の使用促進のための一環として導入されている措置であることから、一般名処方に基づき、先発医薬品を調剤する場合は対象とされていない。
(答) 一般名で記載された先発医薬品に該当していれば、いずれの先発医薬品の薬剤料と比較するものであっても差し支えない。ただし、患者が当該一般名に該当する先発医薬品を既に使用している場合は、当該医薬品の薬剤料と比較すること。
Q&A(H22年調剤報酬改定)
Q.処方箋に記載された医薬品を(1)含量規格が異なる後発医薬品または(2)類似する別剤形の後発医薬品に変更調剤する場合、「患者に対して説明し同意を得ることを条件」に、「変更調剤後の薬剤料が変更前のものと比較して同額以下であるものに限り」認められているが、比較にあたっては薬価(円)でなく、薬剤料(点)によるものと理解してよいか。
A.その通り。
A.差し支えない。
A.(1)および(2)をともに満たすケースについても、変更調剤が認められる。
A.差し支えない。
後発医薬品への変更が可能な処方箋において、先発医薬品と後発医薬品で効能・効果などに違いがある医薬品、先発医薬品の用法・用量または併用薬などから後発医薬品が有しない効能・効果に関わる使用が推測されるなど、後発医薬品への変更にあたり疑義が生じた場合には、処方医に対して照会する必要がある。
先発医薬品等と効能・効果などに違いがある後発医薬品リストについては、「先発医薬品等と効能・効果などに違いがある後発医薬品リスト」を参照(リンク切れの場合は、日本ジェネリック製薬協会HPより)
(注:「↓」の上側が処方箋の記載内容、下側が調剤する内容を示す。)
先発医薬品(10mg錠剤) 1錠
(「錠剤を粉砕すること」との指示あり)
1日1回 朝食後
↓
後発医薬品(散剤) 10mg
1日1回 朝食後
A:差し支えない。
Q&A(H18年調剤報酬改定)
(答)差し支えない。なお、その場合であっても、実際に調剤した医薬品に関する情報について保険薬局から情報提供がなされることが必要。
コメントor補足情報orご指摘あればをお願いします。
記事No2868 題名:Re:通りすがり様 投稿者:管理人tera 投稿日:2024-10-29 12:56:53
通常、先発→先発は疑義がもちろん必要になります。
内服であれば先発25㎎2錠を先発50㎎1錠に変更などです。外用ならモーラス20 14枚をモーラス40 7枚変更などですね。
ただ、このような商品名と全量が同じ中での変更は、別規格(薬価が別になっていない)とはまた違うため、疑義をしなくてもよいと思います。
レセプト的には商品名と100gしか入力しないので切られることはないでしょう。
患者が問題なければ個人的には変えてしまいます。
記事No2867 題名:先発外用剤の規格変更 投稿者:通りすがり 投稿日:2024-10-28 00:56:09
こんばんは
先発(変更不可印なし)→先発(別規格)は疑義が必要ですよね?
例えば
ヒルドイドローション(25g/本) 4本
の処方の場合にヒルドイドローション50g 2本で調剤するには疑義が必要?
記事No2745 題名:Re:tph様 投稿者:管理人tera 投稿日:2024-06-17 16:42:07
確認への返信ありがとうございます。
早速共有させていただきます。
記事No2744 題名:Re:管理人tera 投稿者:tph 投稿日:2024-06-17 16:02:26
はい。おっしゃるような変更調剤が可能と解釈している。と回答いただきました。
記事No2741 題名:Re:tph様 投稿者:管理人tera 投稿日:2024-06-15 19:13:53
はじめまして。
つまり、後発(銘柄名)→先発に変えた場合でも分類間の別剤型の変更調剤が可能ということですか?


