目次
抗凝固薬(DOAC等)一覧と使い方
| 分類 | 成分名 | 商品名 | 規格・剤形・補足 |
|---|---|---|---|
| クマリン系 | ワルファリンK | ワーファリン | 規格:顆粒0.2%、錠0.5mg/1mg/5mg、錠2㎎と細粒0.2%はGEのみ 適応:血栓塞栓症(静脈血栓症、心筋梗塞症、肺塞栓症、脳塞栓症、緩徐に進行する脳血栓症等)の治療及び予防 |
| 抗トロンビン | アルガトロバン | ノバスタンHI スロンノンHI |
規格:注 適応:長いので略 |
| DOAC(直接的トロンビン拮抗薬) | ダビガトラン | プラザキサ | 規格:カプセル75mg/110mg 適応:非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制 |
| DOAC(直接的Xa阻害薬) | リバーロキサバン | イグザレルト | 規格:細粒分包10㎎/15mg/包、錠10mg/15mg、OD錠10㎎/15mg、DS51.7mg/103.4㎎ 適応:【成人】非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制、【小児】静脈血栓塞栓症の治療及び再発抑制、Fontan手術施行後における血栓・塞栓形成の抑制 |
| エドキサバン | リクシアナ | 規格:錠15mg/30mg/60mg、OD錠15mg/30mg/60mg 適応:非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制、静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制、(膝関節全置換術、股関節全置換術、股関節骨折手術)の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制 |
|
| アピキサバン | エリキュース | 規格:錠2.5mg/5mg 適応:非弁膜症性心房細動患者における虚血性脳卒中及び全身性塞栓症の発症抑制 静脈血栓塞栓症(深部静脈血栓症及び肺血栓塞栓症)の治療及び再発抑制 |
|
| 合成Xa阻害薬 | フォンダバリヌクス | アリクストラ | 規格:皮下注 適応:静脈血栓塞栓症の発現リスクの高い、(下肢整形外科手術施行患者、腹部手術施行患者)静脈血栓塞栓症の発症抑制 |
| ヘパリン関連 | ヘパリンNa | ヘパリンナトリウム ヘパフラッシュ |
規格:注 適応:静脈内留置ルート内の血液凝固の防止 |
| ダルテパリン | フラグミン | 規格:静注 | |
| ヘパリンCa | ヘパリンカルシウム | 規格:注、皮下注 適応:血液体外循環時の灌流血液の凝固防止(血液透析)、汎発性血管内血液凝固症(DIC) |
|
| パルナパリン | ローヘパ | 規格:透析用 適応:血液体外循環時の灌流血液の凝固防止(血液透析・血液透析ろ過・血液ろ過) |
|
| エノキサパリン | クレキサン | 規格:皮下注 適応: (股関節全置換術、膝関節全置換術、股関節骨折手術)の下肢整形外科手術施行患者における静脈血栓塞栓症の発症抑制、静脈血栓塞栓症の発症リスクの高い、腹部手術施行患者における静脈血栓塞栓症の発症抑制 5. 効能又は効果に関連する注意 |
|
| ダナパロイド | オルガラン | 規格:静注 適応:汎発性血管内血液凝固症(DIC) |
プラザキサ、イグザレルト、エリキュース、リクシアナと言ったNOAC(non-vitamin K antagonist oral anticoagulants)DOAC(direct oral anticoagulant)と呼ばれる抗凝固薬が続々と発売されて、心原性脳塞栓症という言葉が耳に入る機会が多くなった気がします。
これらの抗凝固薬は、それまでのワーファリンが納豆や青汁といったビタミンKを大量に含む食物を一緒に食べれないことや定期的に血液検査が必要といった煩わしさを淘汰し、期待されて出てきた薬剤です。
そんな矢先にでたプラザキサのブルーレター・・・。これにより、ワーファリンのほうが使いやすいと思ったDrも多いのではないでしょうか。腎代謝80%だから高齢者に使いづらいのが原因で、これがブルーレターの原因となりました。
さて、心原性脳塞栓症とはどういう疾患なのか、ワーファリンやプラザキサ、エリキュース、イグザレルトは抗凝固薬で、パナルジンやプラビックスは抗血小板薬、何が違うのか?
詳しい治療法の説明は、不整脈薬物治療ガイドラインと、2024年JCS/JHRS ガイドラインフォーカスアップデート版に勝るものはないと思います。
抗凝固薬の術前休薬期間
| 一般名(主な商品名) | 休薬開始時期 | 作用持続時間 |
|---|---|---|
| ワルファリンカリウム(ワーファリン) | 3~5日前 | 48~72時間 |
| ダビガトラン(プラザキサ、プリズバインド) | 24時間(重大な手術は2日) | - |
| リバーロキサバン(イグザレルト) | 24時間(重大な手術は2日) | 24時間 |
| アピキサバン(エリキュース) | 2~4日前 | - |
| エドキサバン(リクシアナ) | 24時間 | 24時間 |
心房細動(AF)とは
心房細動は、弁膜症性心房細動と、非弁膜症性心房細動(NVAF)に分類される。
- 弁膜症性心房細動・・・僧帽弁狭窄症や大動脈弁閉鎖不全症のような弁膜疾患によるもの
- 非弁膜症性心房細動(NVAF)・・・高血圧や糖尿病、心不全、血管疾患、甲状腺機能亢進症、自律神経調節異常などを背景とするもの
無秩序に起こる心房の興奮(400~600/min)を原因として起こる心房細動では、まず左心房の拡大による息切れ、上室性期外収縮が引き起こされ、ついで左室の拡大が起こる。BMPも100~200へ上昇する。この際、淀んだ血液が左心耳に滞留し、血栓が形成されてこれが脳に関わらず、いろいろな場所へ行き塞栓症を引き起こす。
心房細動では動悸やめまい、胸痛等の自覚症状が乏しいため、通常、心電図検査を行うか、携帯型ホルター心電図を装着して24時間モニタリングすることで発見されることとなる。
左心房の拡大とその症状は血圧のコントロールにより下げることが可能。
AF治療の流れ
基本の治療は、まず脈を下げる(レートコントロール)。
これにはジギタリス、Ca拮抗薬、β遮断薬が使用される。ジギタリスは動作時の脈は抑えにくいので心不全合併例に?、血圧が低い場合はCa拮抗薬のヘルベッサーやワソラン、血圧が高い場合はメインテートやアーチストがしばしば用いられる。
次に生活習慣病の合併症(DMや高血圧、甲状腺機能亢進症etc...)を取り除く。
その後、腎機能が問題なければDOACを使用(初めからDOACを使用しない。腎機能が悪ければワーファリン)。そして再度レートコントロール。状態により抗不整脈薬を加えたり、貧血を伴うCKD等でOAC服用が好ましくない(出血リスクが高い)時はアブレーションを行う。
ただし、CKD合併例においてはアブレーション後の再発率がきわめて高いため、アブレーションやOACに変わる治療としてLAAC(Left Atrial Appendage Closure:左心耳閉鎖術)という左心耳(LAA)を網目のある風船みたいなもので封鎖して塞栓ができるのを防ぐ治療法が出てきて96%以上の結果(OACの中止)を叩き出している。
また、心房細動の患者へPCIを行った際の、術後の抗血栓薬と抗凝固薬の使用方法については、別ページのPCI(冠動脈インターベンション)を参照。
VTE(静脈血栓塞栓症)とは
VTEはDVT(深部静脈血栓症)とPE(肺塞栓)に分類され、エコノミー症候群とも呼ばれる。
Dダイマー(フィブリンがプラスミンで分解され、FDPが産生→その中の成分で、血栓が形成傾向の指標)が上昇することが特徴。Dダイマー上昇は急性期では可能性が高いが、慢性では陰性であることで除外判断の材料にする程度にすぎない。
DVTは片側性が多い。止血薬やステロイド、女性ホルモンの副作用にも注意する。
DVTの治療には薬物療法としてイグザレルト、エリキュース、リクシアナ、ワーファリンが使用できるが、リクシアナはヘパリン併用が必要であるので、単剤で使いやすいのはイグザレルトとエリキュースの2剤ということになる。
CHADS2スコアとHAS-BLEDスコア
DOACを使用する場合は、CHADS2スコア(心不全:Congestive heart failure、高血圧:Hypertensiton、75歳以上の高齢者:Age、糖尿病:Diabetes mellius、脳梗塞、TIAの既往:Stroke/TIA)を用いて薬剤を選択する。
CHADS2スコアは心房細動(AF)における脳卒中のリスクを評価するために使用される。
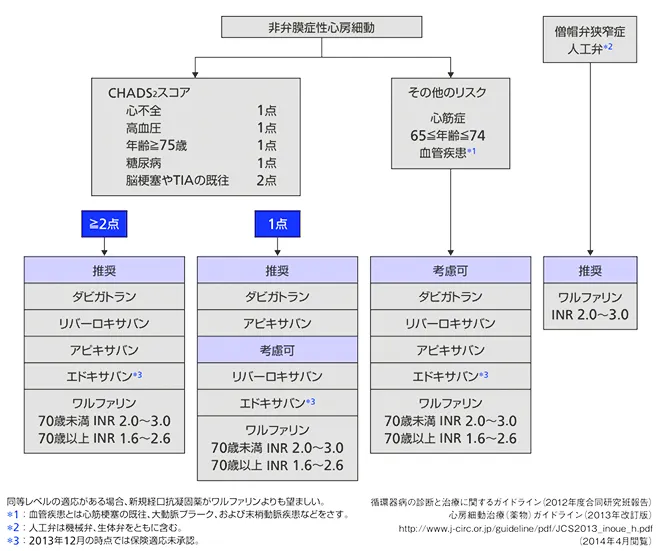
CHADS2スコアが1点を超えるとDOACの使用が考慮される。同スコア1点に考慮可のリバーロキサバンやエドキサバンは未試験という理由なだけで効果が劣るというわけではない。
また、DOACが推奨されるのはNVAFだけであり、弁膜症性心房細動にはワーファリンが推奨されている。
ヨーロッパではもっと詳しいCHA2DS2-VAScが使用されるが、日本ではめんどいという理由でガイドラインでは採用されていない。CHA2DS2-VAScには0点もあるのでより詳しく判定するために用いられたりする。
出血しやすい人の出血リスクの評価のために利用されるのが、HAS-BLEDスコア(高血圧:H、腎障害:A、肝障害:S、出血歴又は出血リスク因子:B、薬物又はアルコールの影響:L、高年齢:E、糖尿病:D)です。
HAS-BLEDスコアは最大で9点、HAS-BLEDスコアが0点であれば、出血リスクは低く、DOACが比較的安全に使用できる。1~2点が中程度の、3点以上が高い出血リスクを表す。3点以上はDOACであっても出血に十分注意する。
CHADS2スコアとHAS-BLEDスコアを併用した上で適切な治療方針を検討する。

経皮的左心耳閉鎖術(LAAC)
経皮的左心耳閉鎖術(LAAC)によく使用されるのが、WATCHMANという左心耳の入口を覆うデバイス(医療機器)です。
WATCHMANは2019年9月に保険承認されており、全身麻酔下、大動脈カテーテルにて留置される。手技時間は約1時間となっている。
経皮的左心耳閉鎖術(LAAC)の適応は、非弁膜症性心房細動(NVAF)であり、
- 脳卒中リスクが高い(CHADS2スコアが高い)
- CHADS2(-VASC)スコアが2点以上
- 出血リスクが高い(HAS-BLEDスコア等が高い)
- HAS-BLEDスコアが3点以上
- 転倒に伴う外傷に対して治療を必要とした既往が複数回ある
- びまん性脳アミロイド血管症の既往がある
- 抗血小板薬の2剤以上の併用が長期間(1年以上)必要である
- 大出血の既往がある
上記項目のうち1つ以上を満たす必要がある。
WATCHMAN等の左心耳留置デバイスによるLAAC術後の標準的な抗血栓療法が以下。

- 最も標準的な治療は1番。45日後の留置デバイスが内皮化して左心耳の閉塞とデバイス血栓がないことを確認(CTかエコー)出来たらOACを終了し、DAPTを180日後まで継続、その後SAPTで継続する方法(半数以上)
- 45日後に閉塞確認が出来ていない場合は、180日後にもう一度確認し、そこでも確認できなければ365日後に強制的にOACを中止させる。間にデバイス血栓の有無も確認する。
LAACとDOACの比較試験(PRAGUE-I7試験)の長期成績(4年)によると、塞栓症のリスクは同等、出血性合併症はLAACで有意に減らせる、消化管出血減少の統計学的結果は示されず。
各抗凝固薬(DOAC)の特徴
各DOACの特徴が以下。
| プラザキサ プリズバインド |
イグザレルト | エリキュース | リクシアナ | |
|---|---|---|---|---|
| 標的因子 | トロンビン | 第Xa因子 | 第Xa因子 | 第Xa因子 |
| T1/2(時間) | 12~14 | 9~13 | 8~15 | 6~11 |
| Tmax(時間) | 0.5~2 | 2~4 | 1~4 | 1~1.5 |
| BA | 6.5%(人) | 67~86%(動物) | 49%(人) | 60%(動物) |
| 蛋白結合率 | 35% | 92~95% | 87% | 40~59% |
| 代謝 | グルクロン酸抱合 | CYP3A4/2J2 | CYP3A4 | CYP3A4 |
| 腎排泄 | 80% | 33% | 25% | 35~39% |
| プロドラッグ | ○ | × | × | × |
DOACはワーファリンに比べて脳出血のリスクは低いものの、消化管出血のリスクが高い。ガイドラインではDOAC使用患者に対するPPI併用は推奨となっている。
胃潰瘍の既往があったり、便潜血が認められる場合はPPI併用が望ましいものの、出血は下部消化管の場合もあることや適応の問題でPPIの全ての患者への予防投与については賛否両論ある。
- 心房細動は全てのタイプの認知症を増やす。
- DOACはワーファリンより出血はもちろんのこと、認知症も減らす。
- イグザレルトとプラザキサは高齢者で出血リスクが高くなるデータ有り
- 心房細動の80歳以上の有病率は6.1%
- やせは心不全再入院に関係する。AFと低体重は心不全の生命予後を悪化する。低体重は脳卒中のリスクだが出血は変わらず。
- 年齢、脳卒中の既往とバイオマーカー(NT-proBNP、Troponins、GDF-15)、CKDが脳卒中を予測する
- AFは加齢、心疾患、動脈硬化指標、CKDと関係する
- フレイルは低体重とCKDと関係し、心房細動の死亡率を増加する。
- CKDでeGFR60以下や心不全では心房細動を合併しやすい
- 85歳以上はCHARsスコアと相談しつつ、本人の意向で出血リスクと相談して続けるかどうかを決める。
ワーファリン(ワルファリンK)
ワーファリンはビタミンKに拮抗することで、上で出てきた四つの血液凝固因子(Ⅱ、Ⅶ、Ⅸ、Ⅹ因子:水色の文字)を抑制してしまうため、Ⅶ因子阻害による頭蓋内出血のリスク(脳内にTFが多いため)や他の凝固因子阻害による他の出血のリスクも高めてしまいます。
プロテインCやプロテインSといった凝固抑制因子も阻害してしまう。
そのため、ワーファリンでは、プロトロンビン時間という血液が固まるまでの時間と、それを指数化したPT-INRを用いて、大体1.6~3.0(通常は2.0前後)に調整することで出血リスクを管理します。
ワーファリンは投与5日目くらいまでは血栓ができやすいのと、ビタミンKで中和後、もとに戻すのに1週間はかかる。
納豆、青汁、クロレラの同時摂取はワーファリンの作用を減弱させるので禁忌。市販の整腸剤に含まれる糖化菌の一つ、納豆菌も禁忌。

ガイドラインではCCr30未満の非透析腎機能障害患者にはワルファリンを用いる。ただし、維持透析患者に対してはワルファリンを使用することは推奨されない。

プラザキサ(ダビガトラン)
プラザキサは直接的トロンビン拮抗薬として、Ⅱa因子(トロンビン)と、トロンビン-TM複合体を阻害する。
メリットは、ワーファリンと違ってビタミンKに拮抗するわけではないので、納豆や青野菜といった食事の制限を受けないこと、頭蓋内や消化管出血のリスクを減らせるということ、PSやPC等のVK依存性の凝固抑制物質を阻害しないことが挙げられる。
デメリットは、生体内に恒常的に存在するトロンビンをも抑制するため、出血リスクが上がることや、トロンビン-TM複合体への親和性のほうが強いために活性化PCの合成を阻害して抗凝固が妨げられること、トロンビンは血小板リン脂質上に存在するXa因子に比して分子自由度が高いため、活性を阻害すると腎排泄が高まるので腎機能障害患者に使いにくい。実際、イグザレルトやエリキュースの腎排泄率が30%前後であるのに対して、プラザキサの腎排泄率は80%である。
比較的メジャーな抗真菌薬イトラコナゾールと併用禁忌である。
吸湿性が高く、アルミピロー包装から出した状態での安定性は3ヶ月、PTPから取り出すと1日持たない。もちろん一包化は不可である。
中等度の腎機能障害、P-糖タンパク質阻害剤の併用、出血リスクの高い患者については減量(110mg)を考慮する。
ワソランとの併用によりプラザキサの血中濃度が上昇することがあるため、プラザキサを服用中にワソランを併用する場合は、併用開始から3日間はワソラン服用の2時間以上前にプラザキサを服用する必要がある(3日間はプラザキサ服用→2時間以上→ワソラン服用)。逆(ワソラン服用中にプラザキサ服用はそのままで併用でOK)。どちらにしても血中濃度を考慮して110mgの使用を考慮すること。
中和剤は、プリズバインド静注液(イダルシズマブ)である。プリズバインドはプラザキサの特異的中和剤。
イグザレルト(リバーロキサバン)、エリキュース(アピキサバン)、リクシアナ(エドキサバン)
イグザレルトとエリキュース、リクシアナは、Xa因子の活性中心のS1ポケットに直接結合してⅩa活性を阻害する薬。
XaはセリンプロテアーゼドメインとEGFドメインとGlaドメインからなっていて、GlaドメインはビタミンK依存性に活性化され、これがあるCaと結合できると同時に膜のリン脂質と結合できるようになる。
メリットは、常に存在している微量なトロンビンを阻害しないのでプラザキサよりも出血リスクが少ないこと、トロンビンよりも上流かつ外因系と内因系のちょうど交わるところを阻害すると効率が良い(XⅠ因子1分子→Xa因子870分子→トロンビン12万分子→フィブリン2億分子)こと、加えてプラザキサと同様のメリットがある。
デメリットは、同用量であっても個人によって効き方が違うため、用量調整には十分注意する必要が有ること。
- 年齢・・・イグザレルト:75歳以上、エリキュース:80歳以上
- 体重・・・イグザレルト:50kg以下、エリキュース:60kg以下
- 腎機能・・・イグザレルト:クレアチニンクリアランス50ml/min以下、エリキュース:血清Cr1.5mg/dL以上
のいずれか2つを満たす場合は用量を減らして投与することはできるものの、低用量を使用したとしてもリスクは格段に上がるため、このような患者にはワーファリンのほうが分がある。
これら3剤には中和剤がないため、保険適用外であるが、他人の血液を入れるという方法がとられることもある。
イグザレルト(半減期:5~9h)、エリキュース(半減期:12h)、リクシアナ(半減期:4.9h)ともにワーファリン(半減期:55~133h)に比べて半減期が短いため、1日2回の投与が望ましく思えるが、イグザレルトとリクシアナの投与回数は1日1回である。
薬価的にはイグザレルト15mgとエリキュース5mg×2が同じくらい、その1.5倍がリクシアナ60mg→ほぼ同じへ統一。ただし、リクシアナの60mgと30mgの価格がほぼ同じのため、30mgを投与されるべき患者に対して60mgを半分に割って投与することで負担が大分軽減される。
イグザレルトの特徴
イグザレルトが1日1回で血中濃度が下がった後の半日間、血液凝固を抑制し続けるメカニズムは以下のようなものである。
- 血管内皮細胞上のTFPIを増加させ(Xaが阻害されるとTFPIがXaに結合できずに温存できるため)、その効果が24時間持続する可能性がある。
- ワーファリンと違ってPSやPCといった凝固抑制因子を阻害しない
- 有効血中濃度でトロンビン生成を強力に阻害するため、ATやトロンボモジュリンなどの消費がなく、温存される
- 上記等の理由で、トラフ濃度でのPT延長が認められなくても、プロトロンビナーゼ複合体を介する凝固時間の延長は持続するため、抗凝固効果が持続している可能性
リクシアナの用法調整基準
リクシアナの用量調整基準(非弁膜症性心房細動、静脈血栓塞栓症)は以下のとおり。
| CLCr(ml/min) | 体重60kg以下 | 体重60kg超※3 | |
|---|---|---|---|
| P糖蛋白阻害作用を有する薬剤※1 | |||
| 併用していない | 併用している | ||
| 50超 | 1日1回30mg | 1日1回60mg | 1日1回30mgに減量(もしくは減量することを考慮) |
| 30以上50以下 | 1日1回30mg | ||
| 15以上30未満 | 投与の適否を慎重に判断 (投与する場合、1日1回30mg) |
||
| 15未満 | 投与不可 | ||
- ※1 1日1回30mgに減量(キニジン硫酸塩水和物、ベラパミル塩酸塩、エリスロマイシン、シクロスポリン)
- ※1 1日1回30mgに減量することを考慮(アジスロマイシン、クラリスロマイシン、イトラコナゾール、ジルチアゼム、アミオダロン、HIVプロテアーゼ阻害薬)
- ※2 出血リスクが高い高齢の患者では、年齢、患者の状態に応じて1日1回15mgに減量できる。(R3.8.27追記)
- ※3 リクシアナ60kg以上へのunderdose(30mg使用)はデータがあり、効果はそれなり、出血リスク低い。
リクシアナが1日1回で血中濃度が下がった後の半日間、血液凝固を抑制し続けるメカニズムとしては、分布容積が大きいため血液中ではなく組織に大部分が分布しているからとされている。
※分布容積:同じ量の薬剤を投与しても薬剤の種類によって血中濃度は異なるのが普通。同じ量の薬剤を投与したのに血中濃度(薬剤の量/血液量)が高ければ血液の量が少なく、逆に低ければ血液の量が多くないとつじつまが合わないが、人の血液の量が薬剤の種類によって増減するということはなく一定である。ここで言う血液の量が分布容積であり、血液量が一定とすれば容積の増減は組織の容積(組織移行性)の増減によるものと見ることができる。こんなかんじかな?

ヘパリン関連薬
ATを介してXaやトロンビンを抑制する薬剤として、ヘパリン、低分子ヘパリン、ダナパロイド、フォンダパリヌクス、アンチトロンビン製剤がある。
ヘパリンは低分子化されるとXa選択性が増し、五単糖の最小単位がフォンダパリヌクスでで最もXa選択性の高いヘパリン関連薬である。
脳梗塞急性期の治療
| 治療法 | 特徴 | 薬剤名 | アテローム | ラクナ | 心原性脳塞栓症 |
|---|---|---|---|---|---|
| 血栓溶解療法 | 発症後4-5時間以内に行う 点滴静注にて血栓を溶解 |
t-PA | ○ | ○ | ○ |
| 局所線溶療法 | 発症後4-5時間以内に行う カテーテルを使って血栓を溶解 |
ウロキナーゼ | ○ | - | ○ |
| 抗凝固療法 | 凝固因子を抑制して血栓を溶解 | ヘパリン アルガトロパン |
○ ○ |
○ - |
○ - |
| 抗血小板療法 | 血小板の抑制して血栓を溶解 | オザグレル アスピリン |
○ - |
○ ○ |
○ ○ |
| 抗浮腫療法 | 頭蓋内圧の上昇を抑制 | 濃グリセリン マンニトール |
○ | - | ○ |
| 脳保護療法 | 活性酸素を抑えて脳組織の壊死を防ぐ | エダラボン | ○ | ○ | ○ |
t-PAは、過去に脳出血既往がある人、脳梗塞の範囲が広い人、抗凝固薬投与中で出血しやすい人、血圧が高い人には使用不可
ワーファリンからDOACへの切り替え
ワーファリン→DOACへの切り替えの場合、ワーファリン投与時におけるPT-INRの基準値は、70歳未満で2.0~3.0、70歳以上で1.6~2.6が普通であり、この治療域にコントロールされている患者さんの場合、ワーファリン中止後、PT-INRが治療域の下限(PT-INRが70歳未満は2未満、70歳以上は1.6未満になってから)を下回ってから切り替える。
ワーファリンの抗凝固効果は通常、経口投与後48~72h持続するが、個人差が大きいので、PT-INRをモニタリングしながら切り替える必要がある。そうすることで、効果の重複による出血リスクを減らすことが出来る。
逆に、DOACからワーファリンへの切り替えの場合、PT-INRが治療域の下限を超えるまでは、両者を併用し、下限を超えたらワーファリン単剤に切り替える。
規格が複数あるDOACからの切り替えは、低用量の規格へ減量しつつワーファリンを併用していく形になるため、詳細は能書を確認すること。
関連ページ
コメントor補足情報orご指摘あればをお願いします。
記事No265 題名:Re:NEO様 投稿者:管理人tera 投稿日:2016-04-20 20:13:04
リクシアナは、Xaを阻害してフィブリンの生成を抑制する薬であり、フィブリンを溶かすプラスミンのような薬ではないので、Dダイマーを上げるということはないのではないでしょうか?
記事No263 題名:Dダイマーと血栓のタイプ別のできる仕組み 投稿者:NEO 投稿日:2016-04-18 23:36:50
すみません。 もう1つ、動脈にできた血栓についてお聞きしてもよろしいでしょうか。
プラスミンによる血栓溶解が抑制されることのことでしたが、リクシアナを服用していたらどうなるのでしょうか?
深部静脈血栓の治療でリクシアナを服用した際に、もし動脈にも血栓があった場合、この血栓も溶けDダイマーの値を上げることはあるのでしょうか。
もしそうなら、リクシアナは動脈の血栓の溶解にも使えるということなのでしょうか?
逆に、使えない場合、なぜ、リクシアナは動脈にできたフェブリンには働かないのでしょうか。
何度もお聞きしてすみませんが、お時間がありましたら、また、よろしくお願いいたします。
記事No261 題名:Re:NEO様 投稿者:管理人tera 投稿日:2016-04-17 18:51:01
はじめまして。
実のところ薬剤師はDrほど病理には詳しくないので(薬理には詳しい)、触りだけ説明させていただきます。これより詳しい説明を当ページをご覧の方でわかる方おられればお願いしたいです。
さて、動脈の血栓の有無にDダイマー検査が使えるか?ですが、あまり有用性がないと思います。
動脈血管内の動脈硬化による傷でももちろん血小板凝集→フィブリンによる二次止血は起こるには起こります。しかしながら、動脈硬化の原因となる高脂血症において、LPa(リポ蛋白a)が高値の場合、このリポ蛋白a(アポAがプラスミノーゲン類似の構造のため)がPAI-1を増加させ、PAI-1はプラスミノーゲンを活性化するt-PAを阻害し、プラスミンによる血栓溶解を抑制、つまりフィブリンの分解抑制→Dダイマー↓となるので静脈血栓症に比べると検査の有用性は低いように思います。
心臓でできる血栓の仕組みは、心房細動→左心房にて血液の滞留→血栓形成↑くらいしか説明できません・・・。すいません。
記事No260 題名:Dダイマーと血栓のタイプ別のできる仕組み 投稿者:NEO 投稿日:2016-04-16 13:50:06
Dダイマー検査について調べていてこちらのサイトにたどり着きました。
とてもわかりやすい内容で、このサイトだけで血栓のことが理解出来ました。
Dダイマー検査についてお伺いしてよろしいでしょうか。
Dダイマー検査はフィブリン血栓が原因で起こる静脈血栓の有無を判断する際に有効な手段だと思っていましたが、動脈の血栓の有無にも使えるという話を聞きました。
血管内の傷が原因でできる血栓の場合、ここではフィブリン分解物質が関与しているようなのでDダイマー検査に反応しそうですが、その他の動脈の血栓はどうなのでしょうか?
Atheroma血栓にもフィブリンが関与しているのでしょうか? 関与して無ければDダイマー検査では判別不能だと思いますが、どうなのでしょうか。
血栓ができるタイプも書いていただけるとわかりやすいと思います。 心臓でできる血栓の仕組みを教えていただければと思います。
よろしくお願いします。
記事No133 題名:Re:勉強中様 投稿者:管理人tera 投稿日:2015-07-11 23:07:27
ご指摘ありがとうございます。
仰るとおり、記述内容の誤りで間違いございません。
講演会でボケーッとしながらメモしてそれをそのまま乗せたら支離滅裂な文になってしまいました。訂正させていただきました。
今後とも宜しくお願い致します。


