鉄(ヘム鉄と非ヘム鉄)の吸収と排泄
鉄の必要摂取量(月経・妊娠中除く)は1日10~15mgで、そのおよそ10%である1mgが十二指腸~空腸上部で吸収される。
生体内の鉄の2/3がヘム鉄(ヘモグロビン+ミオグロビン)として、残りが貯蔵鉄(フェリチン+ヘモジデリン)として組織に貯蔵。赤血球の中のヘモグロビンは酸素を運搬し、筋肉の中のミオグロビンは酸素を筋肉内に貯蔵できる。ミオグロビンが多い哺乳類(イルカとか)は水中で長い時間潜っていられるという。
ヘモジデリンはヘモグロビンが脾臓等で分解されて一部がヘモジデリンとして鉄を含んだ状態で貯蔵される。
生体内の鉄はその大部分が再利用鉄(老廃赤血球がマクロファージにより分解されて生じたもの)で賄えるため、排泄により失う1mg/日程度を食事から補う程度で鉄不足にはならない。
鉄欠乏性貧血の主な症状としては、
- 疲れやすさ(低酸素による)
- 動悸(低酸素を補うために心拍上昇)
- 息切れ(酸素を取り込むため呼吸数が上昇)
- スプーンネイル
- レストレスレッグス
- 嚥下障害
- 異食症(氷など普段食べないものを食べる)
等がある。
ヘム鉄と非ヘム鉄
口から摂取する鉄には大きく、動物(肉魚貝)に含まれるヘム鉄、植物(大豆・緑黄色野菜等)に含まれる非ヘム鉄がある。
ヘム鉄はFe2+とポルフィリンがキレート結合した錯体で、非ヘム鉄はFe2+もしくはFe3+の化合物である。非ヘム鉄はFe3+のみの化合物ではないことに注意する。Fe3+(第二鉄)よりもFe2+(第一鉄)の方が吸収はよい。
Fe2+はFe3+よりも胃腸障害を起こしやすい。ただしヘム鉄は、Fe2+であるが、ポルフィリン環に囲まれているため胃腸障害を起こしにくい。
ヘム鉄の吸収
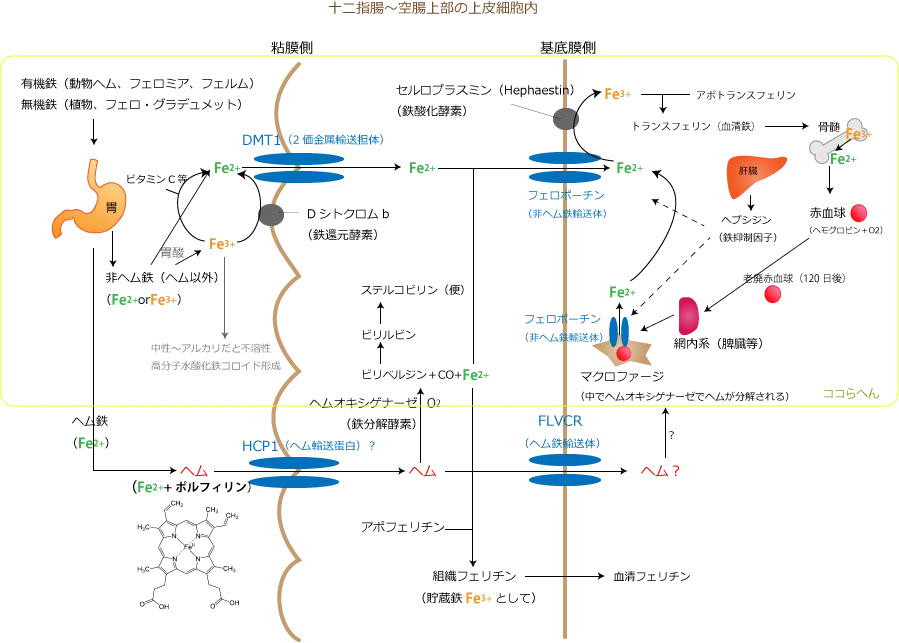
ヘム鉄を含有する肉類やサプリメントを摂取すると、タンパク質が胃酸で分解された後、ヘム鉄はそのままの形で胃を通過し、詳しいメカニズムは未だ未確定とのことだが現時点では、腸管上皮細胞のヘム輸送蛋白HCP1(Heme carrier protein 1=実は葉酸輸送体?)にて上皮細胞内へ移動、そのままの形で基底膜側のヘム鉄輸送体FLVCR(feline leukemia virus, subgroup C, receptor)から血中へと輸送される?
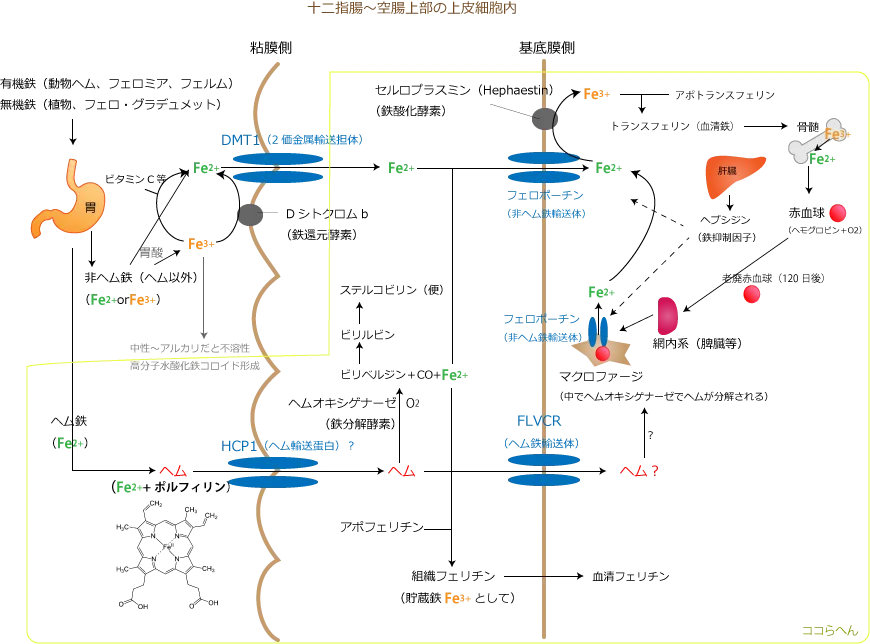
ヘムの分解
ヘムは、一度ヘムを分解する酵素:ヘムオキシゲナーゼ(酸素添加酵素)で分解されてフリーのFe2+にならければヘモグロビン合成には使えない。
ヘムオキシゲナーゼには主に2つのアイソザイムがあり、ヘムオキシゲナーゼ1(HO-1:誘導型)は肝臓、脾臓、マクロファージに、ヘムオキシゲナーゼ2(HO-2:構成型)は肝臓、脳、睾丸、腸上皮細胞内を含む複数の組織に存在する。
古くなった赤血球や食事由来のヘムは、このヘムオキシゲナーゼ(老廃赤血球はマクロファージの)によって、
ヘム + H+ + NADPH + O2 → ビリベルジン + Fe2+ + NADP+ + CO
の作用でヘムのポルフィリン環が壊され、Fe2+を遊離し再利用される。
すなわち、ヘムオキシゲナーゼが赤血球やミオグロビンへと利用できる鉄の調節を行っているといえる。
ヘモグロビンの合成
ヘムの合成
このヘム分解から生じたフリーのFe2+は、腸上皮細胞基底膜側のフェロポーチンから遊離されたFe2+とともに、血清セルロプラスミン(Hephaesin:酸化酵素)の作用でFe3+へと酸化→アポトランスフェリンへ渡され、1つまたは2つ鉄イオンが結合した飽和トランスフェリンとなる。
肝臓から分泌されるヘプシジンはフェロポーチンの活動を抑制して、食事由来の鉄の腸からの吸収を抑制するとともに、鉄の貯蔵細胞からの放出を抑制する。これは鉄の過剰な蓄積を抑制するメカニズムの一つ。
トランスフェリンは骨髄の赤芽球表面にあるトランスフェリン受容体へ結合し、エンドサイトーシスによって赤芽球内に取り込まれる。エンドサイトーシスは細胞が膜をへこませて外部から物質を細胞内へ取り込むプロセスです。
エンドソーム内のpHが下がると、トランスフェリンとFe3+の結合が外れ、フリーのFe3+が放出→NADPHによって還元され、Fe2+となる。
Fe2+はDMT1に結合し、エンドソームから細胞質、ミトコンドリアに運ばれる。
ミトコンドリアと細胞質では以下のようなステップでヘムが合成されます。Fe2+は以下の鉄の挿入のところで使われます。
- デルタ-アミノレブリン酸(ALA)の合成: グリシンとスクシニルCoAが反応し、ミトコンドリアでALAが生成されます。このステップはALA合成酵素によって触媒されます。
- ポルフォビリノーゲンの合成: 細胞質で2分子のALAが結合し、ポルフォビリノーゲンが形成されます。
- ポルフィリン環の形成: ポルフォビリノーゲンから複数の変換を経て、ポルフィリン環を持つ化合物が生成されます。
- 鉄の挿入: ヘム前駆体(プロトポルフィリンIX)に先ほどの鉄イオン(Fe2+)が挿入され、ヘムが完成します。この最終ステップは、鉄イオンをプロトポルフィリンIXの中心に組み込むことにより行われ、ヘムシンターゼ(フェロキラターゼ)によって触媒されます。
グロビンの合成
グロビンは、リボソームで合成されるタンパク質であり、mRNAの指示に従って特定のアミノ酸がペプチド結合を形成し、ポリペプチド鎖が生成されます。ヘモグロビンはα鎖とβ鎖の2種類のグロビン鎖から構成され、これらは異なる遺伝子によってコードされます。
ヘモグロビンの組み立て
ヘムとグロビンの合成が完了すると、ヘム4分子がグロビン(4本のポリペプチド鎖)1分子と結合することでヘモグロビン(Fe2+)を形成する。
ヘモグロビンのFe2+は酸素と結合することができるが、フリーのFe2+のように酸化されてFe3+になることはない。
遊離したフリーのFe2+のうち過剰な分は、アポフェリチンに結合してフェリチンとなり、フェリチンは補足されたFe2+をFe3+の状態で主に肝臓・脾臓・骨髄に貯蔵する(フェリチン重鎖はFe2+からFe3+への酸化作用が強く、軽鎖は鉄をフェリチン内部に取り込む作用がある)。
軽鎖と重鎖の割合は、臓器により異なり、筋肉では重鎖20と軽鎖4,血清では軽鎖のみから構成されている(植物では重鎖のみ)。
組織フェリチンはわずかに血中に漏れ出し(メカニズム不明)、漏れ出した血清フェリチンは貯蔵鉄の量と相関するので、臨床検査に用いる。
赤血球の分解とビリルビン代謝
- 古くなった赤血球は脾臓などの組織で分解されます。この過程でヘモグロビンが解放され、先のヘムの分解で述べた反応で、ビリベルジンと一酸化炭素(CO)、鉄イオンが生じる。
- ビリベルジン還元酵素によってビリベルジンはビリルビンに還元されます。この生成物は間接型ビリルビン(非共役ビリルビン)と呼ばれ、水に溶けにくい特性を持っています。
- 間接型ビリルビンはアルブミンと結合し、この形で肝臓に運ばれます。
肝臓が正常に機能している場合、間接型ビリルビンは迅速にグルクロン酸抱合を受けて、水溶性が増した直接型ビリルビン(共役ビリルビン)に変換されます。肝機能の損傷や胆管閉塞等が起こっていると間接型ビリルビンが適切に抱合されずに血中に逸脱し黄疸が起こります。 - 肝機能正常であれば、抱合を受けた直接型ビリルビンは胆汁の一部として小腸に分泌されます。大腸に到達すると、腸内細菌による脱抱合と還元を受け、ウロビリノーゲンに変換されます。ウロビリノーゲンの約80%は糞便として排泄され、残りの約20%は再吸収されて肝臓に戻り、ビリルビンに再合成されます。
- 大腸でウロビリノーゲンの一部はステルコビリンに変換され、これが大便の茶色の原因となります。また、再吸収されなかったウロビリノーゲンはウロビリンに変換され、尿の黄色をした成分として尿中に排泄されます。
非ヘム鉄の吸収
非ヘム鉄はヘム鉄以外の化合物なので、ヘモグロビンやミオグロビンの存在しない植物中(ひじき等海藻類、ほうれん草等野菜類、大豆等豆類他)の鉄が該当する(全て無機鉄、第二鉄)。
また医薬品として知られている、
- フェロミア(クエン酸第一鉄Na)、有機鉄
- リオナ(クエン酸第二鉄)、有機鉄
- フェルム(フマル酸第一鉄)、有機鉄
- インクレミン(溶性ピロリン酸第二鉄)、有機鉄
- フェロ・グラデュメット(乾燥硫酸鉄)、無機鉄
- スローフィー(乾燥硫酸鉄)、無機鉄(製造中止)
らも、非ヘム鉄である。
第一鉄はFe2+、第二鉄はFe3+(Fe+がないため番号がとんでる)、炭素Cを含む有機鉄(ヘム鉄、クエン酸第一鉄、フマル酸第一鉄等)と炭素を含まない無機鉄(水酸化鉄、硫化鉄、硫酸鉄等)にわけられる。
特徴として有機鉄は溶解にpHの影響を受けにくいが、無機鉄はpHが高いと溶解出来ない。無機鉄は中性では溶解せず、アルカリ側では不溶性高分子水酸化鉄コロイドを形成したりする。
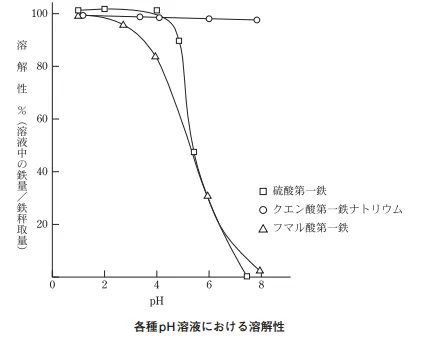
そのため、酸化マグネシウム等の制酸剤との併用は効力が低下するし、食後の胃の酸性度が低下した際に飲むと一般的には低下しやすい。
で、実際の消化経路はというと、
口から入った非ヘム鉄入りの食物や医薬品は、胃酸で分解されて、フリーのFe2+もしくはFe3+が遊離される。
胃内のpHは食前の空腹時でpH1~1.5、食事を摂るとpHは4~5になるが、食後2~3時間でまた空腹時程度のpHに戻る。
したがって、pHの影響を受けにくい有機鉄は食前・食後関係なく分解されるが、無機鉄は空腹時のほうが分解されやすい。
また、腸管からの吸収はFe2+の形で行われるため、第一鉄(Fe2+)を遊離する医薬品に対して、第二鉄(Fe3+)を遊離する食物・医薬品は、一度ビタミンC等の還元剤でFe2+に還元(ただでさえ容易に酸化してFe3+になろうとする鉄イオンではあるが。。。)しておくと吸収率があがる。ちなみに胃酸には酸化力はない。
これが、鉄剤をビタミンC(アスコルビン酸)、クエン酸、リンゴ酸と一緒に服用すると効果が上がる理由である。
逆に、緑茶・コーヒーに含まれるタンニン酸、ほうれん草のシュウ酸、豆類のフィチン酸、食物繊維は、鉄と高分子キレートを形成し吸収が落ちるというのは有名であるが、無機鉄には影響するものの有機鉄にはあまり影響がないとされる。
制酸剤を併用すると、胃内pHの上昇により鉄が水酸基(-OH)と配位結合し、 架橋構造を有する高分子鉄重合体を形成し、 吸収を阻害することが報告されている。これも有機鉄は無機鉄に比べて明らかに高分子鉄重合体の形成が少ないことが報告されている。
続いて腸(十二指腸~空腸上部)へ
吸収は。細胞内へFe2+を輸送する非ヘム鉄輸送体:Divalent Metal Transporter 1(DMT1)により行われる。
フリーのFe3+は腸粘膜側の鉄還元酵素:Duodenum cytochrome b(Dcytb)でFe2+に還元されてから取り込まれる。
腸上皮細胞内に取り込まれたFe2+は、ヘム分解時に遊離されたFe2+とともに、基底膜側のフェロポーチンから遊離され、HephaestinでFe3+→トランスフェリン・・・(以下ヘム鉄と同じ)で赤血球合成に使用される。
腸上皮細胞やマクロファージのフェロポーチンは、肝臓から分泌されるヘプシジンによって発現が調節されている。
ヘプシジンはフェロポーチンと結合し、細胞内リソゾームへと誘導することにより、フェロポーチンを分解へと導く作用を有し、鉄が飽和状態になった時に過剰な鉄の放出を抑える抑制因子として働く。
肝炎・肝硬変等の肝疾患では、ヘプシジンの分泌が悪くなるせいか、鉄の過剰蓄積が起こる。
鉄の排泄
鉄の排泄はおおよそ1日1mg。月経中の女性は+0.5~2mg程度、妊娠中の女性はその10倍以上。
排泄経路は胃腸管からの赤血球のしみ出し、消化管粘膜剥離による細胞中の鉄(フェリチン)、脱落皮膚、汗、毛髪、爪で、糞便は未吸収の鉄、尿中はほとんどなし。
先に述べた通り、実際の吸収率は摂取量の10%ほどであり、残りの9割(未吸収の鉄)は腸内で硫化鉄(FeS:黒色)になって、そのまま便へと排泄される(便の黒色化)。
関連ページ
以下参考・引用元一覧
- 各薬剤IF
- クレデンシャル2016.10(図)
- https://remedics.air-nifty.com/main/2015/03/post-8d6d.html
- https://meddic.jp/%E3%82%A2%E3%83%9D%E3%83%95%E3%82%A7%E3%83%AA%E3%83%81%E3%83%B3
- https://pdbj.org/mom/35
- https://www.tmig.or.jp/J_TMIG/genome300/FTL.html
- https://katosei.jsbba.or.jp/download_pdf.php?aid=33
- https://www.jstage.jst.go.jp/article/naika/104/7/104_1383/_pdf
- https://drug.tokyo.jp/archives/1016
- https://ja.m.wikipedia.org/wiki/%E3%83%98%E3%83%A0
- https://www.ils.co.jp/seihin/hem.html
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


