目次
薬学管理料(特定薬剤(ハイリスク薬)管理指導加算)
- 特定薬剤管理指導加算1・・・
10点- イ 特に安全管理が必要な医薬品が新たに処方された患者に対して必要な指導を行った場合・・・10点
- ロ 特に安全管理が必要な医薬品に係る用法又は用量の変更、患者の副作用の発現状況の変化等に基づき薬剤師が必要と認めて指導を行った場合・・・5点
- 特定薬剤管理指導加算2・・・100点(月1回まで)
- 特定薬剤管理指導加算3
・・・5点(患者1人につき当該品目に関して最初に処方された1回に限り)- イ 特に安全性に関する説明が必要な場合として当該医薬品の医薬品リスク管理計画に基づき製造販売業者が作成した当該医薬品に係る安全管理等に関する資料を当該患者に対して最初に用いた場合・・・5点
- ロ 調剤前に医薬品の選択に係る情報が特に必要な患者に説明及び指導を行った場合・・・10点
概要(調剤報酬点数表、R7改定分1、R7改定分2)
注5 特に安全管理が必要な医薬品として別に厚生労働大臣が定めるものを調剤した場合であって、当該医薬品の服用に関し、その服用状況、副作用の有無等について患者に確認し、必要な薬学的管理及び指導を行ったときには、特定薬剤管理指導加算1
として、10点を次に掲げる点数をそれぞれ所定点数に加算する。
- イ 特に安全管理が必要な医薬品が新たに処方された患者に対して必要な指導を行った場合・・・10点
- ロ 特に安全管理が必要な医薬品に係る用法又は用量の変更、患者の副作用の発現状況の変化等に基づき薬剤師が必要と認めて指導を行った場合・・・5点
注6 別に厚生労働大臣が定める施設基準に適合しているものとして地方厚生局長等に届け出た保険薬局において、別に厚生労働大臣が定める患者に対して、当該患者の副作用の発現状況、治療計画等を文書により確認し、必要な薬学的管理及び指導を行った上で、当該患者の同意を得て、悪性腫瘍の治療に係る薬剤の投薬又は注射に関し、電話等により、その服用状況、副作用の有無等について患者に確認し、保険医療機関に必要な情報を文書により提供した場合には、特定薬剤管理指導加算2として、月1回に限り100点を所定点数に加算する。この場合において、区分番号15の5に掲げる服薬情報等提供料は算定できない。
注7 調剤を行う医薬品を選択するために必要な説明及び指導を行った次に掲げる場合には、特定薬剤管理指導加算3として、患者1人につき当該品目に関して最初に処方された1回に限り、それぞれ5点を次に掲げる点数をそれぞれ所定点数に加算する。
- イ 特に安全性に関する説明が必要な場合として当該医薬品の医薬品リスク管理計画に基づき製造販売業者が作成した当該医薬品に係る安全管理等に関する資料を当該患者に対して最初に用いた場合・・・5点
- ロ
厚生労働大臣の定める評価療養、患者申出療養及び選定療養(平成十八年厚生労働省告示第四百九十五号)第二条第●号に規定する選定療養を受けようとする患者、その他調剤前に医薬品の選択に係る情報が特に必要な患者に説明及び指導を行った場合・・・10点
服薬管理指導料の加算であるので、服薬管理指導料を算定していない場合は算定できない。
補足(調剤報酬点数表に関する事項)
特定薬剤管理指導加算1
(1)特定薬剤管理指導加算1は、服薬管理指導料を算定するに当たって行った薬剤の管理及び指導等に加えて、特に安全管理が必要な医薬品が処方された患者又はその家族等に当該薬剤が特に安全管理が必要な医薬品である旨を伝え、当該薬剤についてこれまでの指導内容等も踏まえ適切な指導を行った場合に算定する。
なお、「薬局におけるハイリスク薬の薬学的管理指導に関する業務ガイドライン」(日本薬剤師会)等を参照し、特に安全管理が必要な医薬品に関して薬学的管理及び指導等を行う上で必要な情報については事前に情報を収集することが望ましいが、薬局では得ることが困難な診療上の情報の収集については必ずしも必要とはしない。
(2) 「イ」については、新たに当該医薬品が処方された場合に限り、算定することができる。
(3) 「ロ」については、次のいずれかに該当する患者に対して指導を行った場合をいう。
- ア 特に安全管理が必要な医薬品の用法又は用量の変更に伴い保険薬剤師が必要と認めて指導を行った患者
- イ 患者の副作用の発現状況、服薬状況等の変化に基づき保険薬剤師が必要と認めて指導を行った患者
(4)特に安全管理が必要な医薬品とは、
- 抗悪性腫瘍剤
- 免疫抑制剤
- 不整脈用剤
- 抗てんかん剤
- 血液凝固阻止剤(
ワルファリンカリウム、チクロピジン塩酸塩、クロピドグレル硫酸塩及びシロスタゾール並びにこれらと同様の薬理作用を有する成分を含有する内服薬に限る。) - ジギタリス製剤
- テオフィリン製剤
- カリウム製剤(注射薬に限る)
- 精神神経用剤
- 糖尿病用剤
- 膵臓ホルモン剤
- 抗HIV薬
をいう。
なお、具体的な対象薬剤については、その一覧を厚生労働省のホームページに掲載している。
(5)特に安全管理が必要な医薬品が複数処方されている場合には、そのすべてについて必要な保険薬剤師が必要と認める薬学的管理及び指導を行うこと。ただし、この場合において、当該加算は処方箋の受付1回につき1回に限り算定する。ものであること。なお、「イ」及び「ロ」のいずれにも該当する場合であっても、重複して算定することはできない。
(6)対象となる医薬品に関して患者又はその家族等に対して確認した内容及び行った指導の要点について、薬剤服用歴等に記載すること。なお、従来と同一の処方内容にもかかわらず当該加算を継続して算定する場合には、の場合は、「ロ」として特に指導が必要と保険薬剤師が認めた場合に限り算定することができるが、この場合において、特に指導が必要な内容を重点的に行い、その内容をと判断した理由の要点を薬剤服用歴等に記載すること。
※デパスは1日3mg以上でなければ取れないと思って良い。βブロッカーも血圧での使用でないことをきちんと確認しておく必要がある。
特定薬剤管理指導加算2
(1) 特定薬剤管理指導加算2は、医科点数表「B001-2-12」の「注6」に規定する連携充実加算を届け出ている保険医療機関において、抗悪性腫瘍剤を注射された悪性腫瘍の患者に対して、抗悪性腫瘍剤等を調剤する保険薬局の保険薬剤師が以下のアからウまでの全てを実施した場合に算定する。
- ア 当該患者のレジメン(治療内容)等を確認し、必要な薬学的管理及び指導を行うこと。
- イ 当該患者が注射又は投薬されている抗悪性腫瘍剤及び制吐剤等の支持療法に係る薬剤に関し、電話等により服用状況、患者の服薬中の体調の変化(副作用が疑われる症状など)の有無等について患者又はその家族等に確認すること。
- ウ イの確認結果を踏まえ、当該保険医療機関に必要な情報を文書により提供すること。
(2) 「抗悪性腫瘍剤等を調剤する保険薬局」とは、患者にレジメン(治療内容)等を交付した保険医療機関の処方箋に基づき、保険薬剤師が抗悪性腫瘍剤又は制吐剤等の支持療法に係る薬剤を調剤する保険薬局をいう。
(3) 特定薬剤管理指導加算2における薬学的管理及び指導を行おうとする保険薬剤師は、原則として、保険医療機関のホームページ等でレジメン(治療内容)等を閲覧し、あらかじめ薬学的管理等に必要な情報を把握すること。
(4) 電話等による患者の服薬状況及び患者の服薬中の体調の変化(副作用が疑われる症状など)の有無等の確認は、電話の他、リアルタイムでの画像を介したコミュニケーション(以下「ビデオ通話」という。)による連絡及び患者が他の保険医療機関の処方箋を持参した際の確認が含まれる。電話又はビデオ通話により患者に確認を行う場合は、あらかじめ患者に対し、電話又はビデオ通話を用いて確認することについて了承を得ること。
(5) 患者の緊急時に対応できるよう、あらかじめ保険医療機関との間で緊急時の対応方法や連絡先等について共有することが望ましい。また、患者の服薬状況の確認において、重大な副作用の発現のおそれがある場合には、患者に対して速やかに保険医療機関に連絡するよう指導することや受診勧奨を行うことなどにより、必要な対応を行うこと。
(6) 保険医療機関に対して情報提供した文書の写し又はその内容の要点等を薬剤服用歴の記録に添付又は記載する。
(6) 当該加算の算定時に行う保険医療機関への文書による情報提供については、服薬情報等提供料は算定できない。
(7) 特定薬剤管理指導加算2は、特別調剤基本料Aを算定している保険薬局において、当該保険薬局と不動産取引等その他特別な関係を有している保険医療機関へ情報提供を行った場合は算定できない。
(8) 患者1人につき同一月に2回以上の情報提供を行った場合においても、当該加算の算定は月1回のみとする。
(9) 抗悪性腫瘍剤等に関する患者の服用状況及び患者の服薬中の体調の変化(副作用が疑われる症状など)の有無等の確認を行う際に、他の保険医療機関又は他の診療科で処方された薬剤に係る情報を得た場合には、必要に応じて、患者の同意を得た上で、当該他の保険医療機関等に情報提供を行うこと。この場合において、所定の要件を満たせば服薬情報等提供料を算定できる。
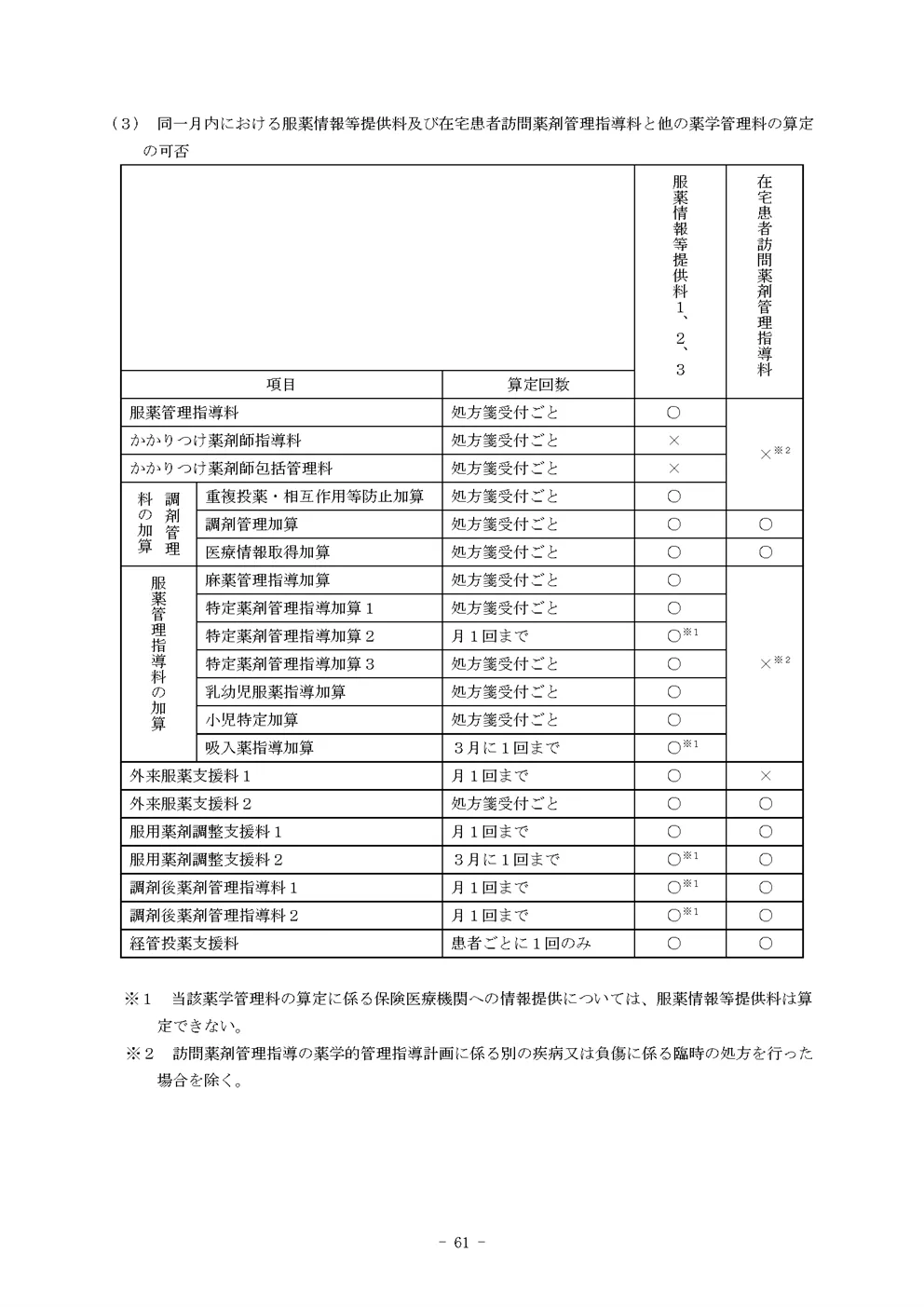
特定薬剤管理指導加算3
(1) 服薬管理指導料を算定するに当たって行った薬剤の管理及び指導等に加えて、処方された医薬品について、保険薬剤師が患者に重点的な服薬指導が必要と認め、必要な説明及び指導を行ったときに患者1人につき当該医薬品に関して最初に処方された1回に限り算定する。
(2) 「イ」については、「10の2」調剤管理料の1の(1)を踏まえ、「当該医薬品の医薬品リスク管理計画に基づき製造販売業者が作成した当該医薬品に係る安全管理等に関する資料を当該患者に対して最初に用いた場合」とは、以下のいずれかの場合をいう。
- RMPの策定が義務づけられている医薬品について、当該医薬品を新たに処方された場合に限り、患者又はその家族等に対し、RMPに基づきRMPに係る情報提供資材を活用し、副作用、併用禁忌等の当該医薬品の特性を踏まえ、適正使用や安全性等に関して十分な指導を行った場合
- 処方された薬剤について緊急安全性情報、安全性速報が新たに発出された場合等に、安全性に係る情報について提供及び十分な指導を行った場合
(3) 「ロ」に示す「調剤前に医薬品の選択に係る情報が特に必要な患者に説明及び指導を行った場合」とは、以下のいずれかの場合をいう。
- 後発医薬品が存在する先発医薬品であって、一般名処方又は銘柄名処方された医薬品について、選定療養の対象となる先発医薬品を選択しようとする患者に対して説明を行った場合
- 医薬品の供給の状況が安定していないため、調剤時に前回調剤された銘柄の必要な数量が確保できず、前回調剤された銘柄から別の銘柄の医薬品に変更して調剤された薬剤の交付が必要となる患者に対して説明を行った場合
(4) 対象となる医薬品が複数処方されている場合に、処方箋受付1回につきそれぞれ1回に限り算定するものであること。また、複数の項目に該当する場合であっても、重複して算定することができない。
(5) 特定薬剤管理指導加算3を算定する場合は、それぞれの所定の要件を満たせば特定薬剤管理指導1及び特定薬剤管理指導加算2を算定できる。
(6) 薬剤服用歴等には、対象となる医薬品が分かるように記載すること。また、医薬品の供給の状況を踏まえ説明を行った場合には、調剤報酬明細書の摘要欄に調剤に必要な数量が確保できなかった薬剤名を記載すること。
補足(特掲診療料の施設基準等の一部を改正する件、別表第三の三)
十の三 特定薬剤管理指導加算2の施設基準
当該管理及び指導等を行うにつき必要な体制が整備されていること。
服薬管理指導料及びかかりつけ薬剤師指導料に規定する医薬品
別表第三の三に掲げる医薬品
- 抗悪性腫瘍剤
- 免疫抑制剤
- 不整脈用剤
- 抗てんかん剤
- 血液凝固阻止剤(内服薬に限る。)
- ジギタリス製剤
- テオフィリン製剤
- カリウム製剤(注射薬に限る。)
- 精神神経用剤
- 糖尿病用剤
- 膵臓ホルモン剤
- 抗HIV薬
服薬管理指導料の注6/かかりつけ薬剤師指導料の注4(特定薬剤管理指導加算2)に規定する厚生労働大臣が定める患者
次のいずれにも該当する患者であること。
- (1)医科点数表区分番号B001-2-12に掲げる外来腫瘍化学療法診療料の注6に規定する連携充実加算を届け出ている保険医療機関において、化学療法(抗悪性腫瘍剤が注射されている場合に限る。)及び必要な指導が行われている悪性腫瘍の患者
- (2)当該保険薬局において、悪性腫瘍の治療に係る薬剤の調剤を受ける患者
特掲診療料の施設基準等及びその届出に関する手続きの取扱いについて(本文)
第1 略
第2 届出に関する手続き
1 特掲診療料の施設基準等に係る届出に際しては、特に規定のある場合を除き、当該保険医療機関単位又は当該保険薬局単位で行うものであること。
2 「特掲診療料の施設基準等」の各号に掲げる施設基準に係る届出を行おうとする保険医療機関又は保険薬局の開設者は、当該保険医療機関又は保険薬局の所在地の地方厚生(支)局長に対して、別添2の当該施設基準に係る届出書(届出書添付書類を含む。以下同じ。)を1通提出するものであること。なお、国立高度専門医療研究センター等で内部で権限の委任が行われているときは、病院の管理者が届出書を提出しても差し支えない。また、当該保険医療機関は、提出した届出書の写しを適切に保管するものであること。
3 届出書の提出があった場合は、届出書を基に、「特掲診療料の施設基準等」及び本通知に規定する基準に適合するか否かについて要件の審査を行い、記載事項等を確認した上で受理又は不受理を決定するものであること。また、補正が必要な場合は適宜補正を求めるものとする。なお、この要件審査に要する期間は原則として2週間以内を標準とし、遅くとも概ね1か月以内(提出者の補正に要する期間は除く。)とするものであること。
4 届出に当たっては、当該届出に係る基準について、特に定めがある場合を除き、実績期間を要しない。
ただし、以下に定める施設基準については、それぞれ以下に定めるところによる。
--(1)~(15)略--
5 特掲診療料の施設基準等に係る届出を行う保険医療機関又は保険薬局が、次のいずれかに該当する場合にあっては当該届出の受理は行わないものであること。
- (1) 当該届出を行う前6か月間において当該届出に係る事項に関し、不正又は不当な届出(法令の規定に基づくものに限る。)を行ったことがある保険医療機関又は保険薬局である場合。
- (2) 当該届出を行う前6か月間において療担規則及び薬担規則並びに療担基準に基づき厚生労働大臣が定める掲示事項等(平成18年厚生労働省告示第107号)に違反したことがある保険医療機関又は保険薬局である場合。
- (3) 地方厚生(支)局長に対して当該届出を行う時点において、厚生労働大臣の定める入院患者数の基準及び医師等の員数の基準並びに入院基本料の算定方法(平成18年厚生労働省告示第104号)に規定する基準のいずれかに該当している保険医療機関である場合。
- (4) 当該届出を行う前6か月間において、健康保険法(大正11年法律第70号)第78条第1項(同項を準用する場合を含む。)及び高齢者の医療の確保に関する法律(昭和57年法律第80号)(以下「高齢者医療確保法」という。)第72条第1項の規定に基づく検査等の結果、診療内容若しくは調剤内容又は診療報酬若しくは調剤報酬の請求に関し、不正又は不当な行為が認められた保険医療機関又は保険薬局である場合。なお、「診療内容又は診療報酬の請求に関し、不正又は不当な行為が認められた場合」とは、「保険医療機関及び保険医等の指導及び監査について」(平成12年5月31日保発第105号厚生省保険局長通知)に規定する監査要綱に基づき、戒告若しくは注意又はその他の処分を受けた場合をいうものとする。
6 届出の要件を満たしている場合は届出を受理し、次の受理番号を決定し、提出者に対して副本に受理番号を付して通知するとともに、審査支払機関に対して受理番号を付して通知するものであること。
- --複数行略---
- 特別調剤基本料A (特調基A)第〇号
- 調剤基本料1 (調基1)第○号
- 調剤基本料2 (調基2)第○号
- 調剤基本料3イ (調基3イ)第○号
- 調剤基本料3ロ (調基3ロ)第○号
- 調剤基本料3ハ (調基3ハ)第○号
- 調剤基本料1(注1のただし書に該当する場合) (調基特1)第○号
- 地域支援体制加算1 (地支体1)第○号
- 地域支援体制加算2 (地支体2)第○号
- 地域支援体制加算3 (地支体3)第○号
- 地域支援体制加算4 (地支体4)第○号
- 連携強化加算 (薬連強)第〇号
- 後発医薬品調剤体制加算1 (後発調1)第○号
- 後発医薬品調剤体制加算2 (後発調2)第○号
- 後発医薬品調剤体制加算3 (後発調3)第○号
- 無菌製剤処理加算 (薬菌)第○号
- 在宅薬学総合体制加算1 (在薬総1)第 号
- 在宅薬学総合体制加算2 (在薬総2)第 号
- 医療DX推進体制整備加算 (薬DX)第 号
在宅患者調剤加算 (在調)第○号- 特定薬剤管理指導加算2 (特薬管2)第○号
- かかりつけ薬剤師指導料及びかかりつけ薬剤師包括管理料 (か薬)第○号
- 在宅患者医療用麻薬持続注射療法加算 (在医麻)第〇号
- 在宅中心静脈栄養法加算 (在中栄)第〇号
7 略
8 4に定めるもののほか、各月の末日までに要件審査を終え、届出を受理した場合は、翌月の1日から当該届出に係る診療報酬を算定する。また、月の最初の開庁日に要件審査を終え、届出を受理した場合には当該月の1日から算定する。なお、令和4年までに届出書の提出があり、同月末日までに要件審査を終え届出の受理が行われたものについては、同月1日に遡って算定することができるものとする。令和6年6月1日からの算定にかかわる届出については、令和6年5月2日以降に届出書の提出を行うことができる。
9 届出の不受理の決定を行った場合は、速やかにその旨を提出者にして通知するものであること。
第3 届出受理後の措置等
1 届出を受理した後において、届出の内容と異なった事情が生じ、当該施設基準を満たさなくなった場合又は当該施設基準の届出区分が変更となった場合には、保険医療機関又は保険薬局の開設者は届出の内容と異なった事情が生じた日の属する月の翌月に変更の届出を行うものであること。
ただし、神経学的検査、画像診断管理加算1及び2、麻酔管理料(Ⅰ)、歯科矯正診断料並びに顎口腔機能診断料について届け出ている医師に変更があった場合にはその都度届出を行い、届出にあたり使用する機器を届け出ている施設基準については、当該機器に変更があった場合には、その都度届出を行うこと。また、CT撮影及びMRI撮影について届け出ている撮影に使用する機器に変更があった場合にはその都度届出を行うこと。その場合においては変更の届出を行った日の属する月の翌月(変更の届出について、月の最初の開庁日に要件審査を終え、届出を受理された場合には当該月の1日)から変更後の特掲診療料を算定すること。
ただし、面積要件や常勤職員の配置要件のみの変更の場合など月単位で算出する数値を用いた要件を含まない施設基準の場合には、当該施設基準を満たさなくなった日の属する月に速やかに変更の届出を行い、当該変更の届出を行った日の属する月の翌月から変更後の特掲診療料を算定すること。
2 届出を受理した保険医療機関又は保険薬局については、適時調査を行い(原則として年1回、受理後6か月以内を目途)、届出の内容と異なる事情等がある場合には、届出の受理の変更を行うなど運用の適正を期するものであること。
3 「特掲診療料の施設基準等」に適合しないことが判明した場合は、所要の指導の上、変更の届出を行わせるものであること。その上で、なお改善がみられない場合は、当該届出は無効となるものであるが、その際には当該保険医療機関又は当該保険薬局の開設者に弁明を行う機会を与えるものとすること。
4 届出を行った保険医療機関又は保険薬局は、毎年7月1日8月1日現在で届出の基準の適合性を確認し、その結果について報告を行うものであること。
5 地方厚生(支)局においては、届出を受理した後、当該届出事項に関する情報を都道府県に提供し、相互に協力するよう努めるものとすること。
6 届出事項については、被保険者等の便宜に供するため、地方厚生(支)局において閲覧(ホームページへの掲載等を含む。)に供するとともに、当該届出事項を適宜とりまとめて、保険者等に提供するよう努めるものとする。また、保険医療機関及び保険薬局においても、保険医療機関及び保険医療養担当規則(昭和32年厚生省令第15号。以下「療担規則」という。)、高齢者の医療の確保に関する法律の規定による療養の給付等の取扱い及び担当に関する基準(昭和58年厚生省告示第14号。以下「療担基準」という。)及び保険薬局及び保険薬剤師療養担当規則(昭和32年厚生省令第16号)の規定に基づき、院内の見やすい場所に届出内容の掲示を行うよう指導をするものであること。
※生じた日(1月)→翌月(2月)に変更届提出→受理→翌月(3月)から算定ということ。ただし、月の1日に受理されればその月から算定可能。
第4 経過措置等
第2及び第3の規定にかかわらず、令和4年3月31日令和6年5月31日現在において現に特掲診療料を算定している保険医療機関及び保険薬局において、引き続き当該特掲診療料を算定する場合(名称のみが改正されたものを算定する場合を含む。)には、新たな届出を要しない。ただし、令和4年4月令和6年6月以降の実績により、届出を行っている特掲診療料の施設基準等の内容と異なる事情等が生じた場合は、変更の届出を行うこと。また、令和6年度診療報酬改定において、新設された又は施設基準が創設された特掲診療料(表1)及び施設基準が改正された特掲診療料(表2)のうち届出が必要なものについては、令和4年4月1日令和6年6月1日以降の算定に当たり届出を行う必要があること。なお、表2における経過措置期間については、令和6年3月 31 日時点で改正前の特掲診療料の届出を行っている保険医療機関についてのみ適用される。
表1 新設された又は施設基準が創設された特掲診療料
- 在宅薬学総合体制加算
- 医療DX推進体制整備加算
表2 施設基準の改正された特掲診療料(届出が必要なもの)
調剤基本料2- 特別調剤基本料A
- 調剤基本料の注1ただし書に規定する施設基準(処方箋集中率等の状況によらず例外的に調剤基本料1を算定することができる保険薬局)(令和8年6月1日以降に引き続き算定する場合に限る。)
調剤基本料の注4に規定する保険薬局- 地域支援体制加算(令和8年9月1日以降に引き続き算定する場合に限る。)
- 連携強化加算(令和7年1月1日以降に引き続き算定する場合に限る。)
表3 施設基準の改正された特掲診療料(届出が必要でないもの)
- 調剤基本料2
- 調剤基本料の注2に規定する保険薬局
- 調剤基本料の注4に規定する保険薬局
- 調剤管理加算
- 医療情報取得加算
- 服薬管理指導料の注14 に規定する保険薬剤師(かかりつけ薬剤師と連携する他の薬剤師が対応した場合)
表4 施設基準等の名称が変更されたが、令和4年令和6年3月31日において現に当該点数を算定していた保険医療機関及び保険薬局であれば新たに届出が必要でないもの
- 該当なし
特掲診療料の施設基準等及びその届出に関する手続きの取扱いについて(別添)
特定薬剤管理指導加算2
1 特定薬剤管理指導加算2に関する施設基準
(1) 施設基準の届出時点において、保険薬剤師としての勤務経験を5年以上有する薬剤師が勤務していること。なお、保険医療機関の薬剤師としての勤務経験を1年以上有する場合、1年を上限として保険薬剤師としての勤務経験の期間に含めることができる。
(2) 薬学的管理等の内容が他の患者に漏れ聞こえる場合があることを踏まえ、患者との会話のやりとりが他の患者に聞こえないようパーテーション等で区切られた独立したカウンターを有するなど、患者のプライバシーに配慮していること。
(3) 麻薬及び向精神薬取締法第3条の規定による麻薬小売業者の免許を取得し、必要な指導を行うことができる体制が整備されていること。
(4) 保険医療機関が実施する抗悪性腫瘍剤の化学療法に係る研修会に当該保険薬局に勤務する常勤の保険薬剤師が年1回以上参加していること。
(5) 令和2年9月30 日までの間は、(4)による基準を満たしているものとする。
2 届出に関する事項
特定薬剤管理指導加算2の施設基準に係る届出は、別添2の様式92 を用いること。
届出の注意点
加算要件を満たさなくなった場合は、辞退届を提出する。
届出は電子申請(保険医療機関等電子申請・届出等システム)にも対応しています。


ハイリスク薬の薬学的管理指導
以下、ハイリスク薬の薬学的管理指導において特に注意すべき事項を列挙する。これ以外の医薬品についても、それぞれの薬局の実情に応じて業務に取り入れていくことが望ましい。
- 抗悪性腫瘍剤
- 患者に対する処方内容(薬剤名、用法・用量、投与期間、休薬期間等)の確認
- 化学療法に対する不安への対応/li>
- 他剤との相互作用などの確認
- 副作用の防止及び副作用の早期発見とその対策
- 患者に最適な疼痛緩和のための情報収集、処方提案と患者への説明
- 可能である場合、腫瘍マーカー等による治療効果の確認
- 外来化学療法実施の際に受けた指導内容や提供された情報の確認
- 支持療法の処方・使用の確認あるいは必要に応じた指示療法の提案など
- 一般用医薬品やサプリメントを含め、併用薬や相互作用発現の確認
- 緩和治療における麻薬等の使用状況の確認
- 不整脈用剤
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 体調変化(ふらつき、動機、低血糖の副作用症状)の有無の確認
- 最近の発作状況を聞き取り、薬剤の効果が得られているかの確認
- QT延長を起こしやすい薬剤等、併用薬による症状の変化のモニタリング
- 抗てんかん剤
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 服用患者のアドヒアランスの確認
- 最近の発作状況を聞き取り、薬剤の効果が得られているかなどの確認(過小投与量設定による効果不十分に注意)
- 一般用医薬品やサプリメントを含め、併用薬や相互作用発現の確認
- 血液凝固阻止剤(ワルファリンカリウム、塩酸チクロピジン、硫酸クロピドグレル及びシロスタゾール並びにこれらと同様の薬理作用を有する成分を含有する内服薬に限る。)
- 患者に対する処方内容(薬剤名、用法・用量)の確認
- 服用患者のアドヒアランスの確認
- 服薬管理の徹底(検査・手術前・抜歯時の服薬休止、検査・手術後抜歯後の服薬再開の確認)
- 併用薬や食事(納豆等)、一般用医薬品や健康食品との相互作用の指導
- 服用中は出血傾向となるので、過量投与の兆候(あざ、歯茎からの出血等)の確認とその対策
- 日常生活(閉経前の女性に対する生理中の生活指導など)での注意点の指導
- 血液検査が行われているかの確認と、可能であればその検査データの確認
- ジギタリス製剤
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- ジギタリス中毒症状(食欲不振、悪心・嘔吐、めまい、頭痛、不整脈の出現)が発現していないか確認とその対策
- K排泄型利尿薬やCa含有製剤、β遮断薬等の併用薬との相互作用の注意と、可能であれば血清電解質の検査データの確認
- テオフィリン製剤
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 喫煙、カフェイン摂取等の嗜好歴及び健康食品の摂取状況の確認と相互作用の確認
- 一般用医薬品やサプリメント等との重複使用、相互作用などの確認
- 服用による悪心、嘔吐、けいれん、頻脈等の副作用症状について説明し、体調変化の有無及びアドヒアランスの確認
- 精神神経用剤
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 原疾患の症状と類似した副作用(錐体外路症状、パーキンソン症候群等)や致死的副作用(悪性症候群、セロトニン症候群等)のモニタリング
- 特に非定型抗精神病薬では、血液疾患、内分泌疾患などの副作用モニタリング
- 薬識が不足している患者及び患者家族への教育とアドヒアランス
- 薬物の依存傾向を示す患者などに対して、治療開始時における適正な薬物療法に関する情報を提供
- 自殺企図等による過量服用の危険性のある患者の把握と服薬管理の徹底
- 転倒に関する注意喚起
- 糖尿病薬
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 低血糖及び低血糖常態出現時の対処法の指導
- 低血糖出現(他の糖尿病薬との併用や高齢者、服用量や服用時間の誤り、食事摂取をしなかった場合)等に注意し、ブドウ糖携帯の指導
- 服用時間の確認、服用忘れ時の対処法についての指導
- Sick Day時の対処法についての指導
- 可能である場合、グリコヘモグロビンA1cや血糖値の測定結果などによる治療経過の確認
- すい臓ホルモン剤
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 低血糖及び低血糖状態出現時の対処法の指導
- 低血糖出現(他の糖尿病薬との併用や高齢者、服用量や服用時間の誤り、食事摂取をしなかった場合)等に注意し、ブドウ糖携帯の指導
- 注射手技の確認
- 薬剤の保管方法、空うちの意義、投与部位についての説明
- 注射針の取扱い方法についての指導
- Sick Day時に対処法についての指導
- 免疫抑制剤
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 感染症の発症や悪化防止のための注意事項の患者への説明
- 一般医薬品やサプリメント等の併用やグレープフルーツ等の飲食物や食事との相互作用の聞き取り、確認
- 症状や検査値(可能である場合)などの確認による治療経過と副作用モニタリング
- 抗HIV薬
- 患者に対する処方内容(薬剤名、用法・用量等)の確認
- 服用する回数や時間がライフスタイルと合致しているかの確認
- アドヒアランス低下による薬剤耐性HIV出現リスクに対する説明
- 併用薬や健康食品などとの相互作用の指導
- 重大な副作用の発見のため、発熱、発疹等の初期症状について指導し、体調変化の有無について確認(副作用モニタリング)
- 服薬状況の確認
- 症状や検査値(可能である場合)などの確認による治療経過と副作用モニタリング
ハイリスク薬の薬剤服用歴管理指導の業務手順と方法
以下、ハイリスク薬を対象とした薬学的管理指導を行う場合にとるべき標準的な方法を列挙する。
- 1、患者情報、臨床所見及び使用薬剤に関する十分な情報と知識に基づいて、患者の薬学的管理を行う。
- 2、以下の情報などを患者に説明する際には、患者の理解を深めるため、必要に応じて薬剤情報提供文書などを編集し活用する。また、最も重要な情報は反復させて患者の理解度を確認する。
- 1、薬剤の効果:どういう効果があるか、何時頃効果が期待できるか
- 2、副作用:どのような副作用が起こりうるか、何時頃から、どのように自覚されるか
- 3、服薬手順:どのように、いつ、いつまで服用するか、食事との関係、最大容量、服用を継続する意義
- 4、注意事項:保管方法、残薬の取扱い、自己判断による服薬や管理の危険性
- 5、再診の予定:いつ再診するか、予定より早く受診するのはどのような時か
- 3、指導内容などを正確に記録する。特に検査値やバイタルサインの情報を得られたときには、副作用発現の可能性の有無について薬学的な視点から検討を行う。
- 4、問題点を明確にし、記録を基に薬学的見地に立った見解及び情報を、主治医等に必要に応じて適切に提供する。
- 5、応需処方箋の医療機関以外の処方箋や一般用医薬品、退院時の服薬に関する注意事項などの情報に気を配り、応需処方箋に限定されない包括的な薬学的管理に努める。
薬効分類番号
薬効分類番号を調べる時は添付文書右上の日本標準商品分類番号を見ると良い。

| 薬効分類コード 薬効分類名 |
|---|
| 111 全身麻酔剤 |
| 112 催眠鎮静剤,抗不安剤 |
| 113 抗てんかん剤 |
| 114 解熱鎮痛消炎剤 |
| 115 興奮剤,覚醒剤 |
| 116 抗パーキンソン剤 |
| 117 精神神経用剤 |
| 118 総合感冒剤 |
| 119 その他の中枢神経系用薬 |
| 121 局所麻酔剤 |
| 122 骨格筋弛緩剤 |
| 123 自律神経剤 |
| 124 鎮けい剤 |
| 125 発汗剤,止汗剤 |
| 129 その他の末梢神経系用薬 |
| 131 眼科用剤 |
| 132 耳鼻科用剤 |
| 133 鎮暈剤 |
| 139 その他の感覚器官用薬 |
| 211 強心剤 |
| 212 不整脈用剤 |
| 213 利尿剤 |
| 214 血圧降下剤 |
| 215 血管補強剤 |
| 216 血管収縮剤 |
| 217 血管拡張剤 |
| 218 高脂血症用剤 |
| 219 その他の循環器官用薬 |
| 221 呼吸促進剤 |
| 222 鎮咳剤 |
| 223 去たん剤 |
| 224 鎮咳去たん剤 |
| 225 気管支拡張剤 |
| 226 含嗽剤 |
| 229 その他の呼吸器官用薬 |
| 231 止しゃ剤,整腸剤 |
| 232 消化性潰瘍用剤 |
| 233 健胃消化剤 |
| 234 制酸剤 |
| 235 下剤,浣腸剤 |
| 236 利胆剤 |
| 237 複合胃腸剤 |
| 239 その他の消化器官用薬 |
| 241 脳下垂体ホルモン剤 |
| 242 唾液腺ホルモン剤 |
| 243 甲状腺,副甲状腺ホルモン剤 |
| 244 たん白同化ステロイド剤 |
| 245 副腎ホルモン剤 |
| 246 男性ホルモン剤 |
| 247 卵胞ホルモン及び黄体ホルモン剤 |
| 248 混合ホルモン剤 |
| 249 その他のホルモン剤(抗ホルモン剤を含む。) |
| 251 泌尿器官用剤 |
| 252 生殖器官用剤(性病予防剤を含む。) |
| 253 子宮収縮剤 |
| 254 避妊剤 |
| 255 痔疾用剤 |
| 259 その他の泌尿生殖器官及び肛門用薬 |
| 261 外皮用殺菌消毒剤 |
| 262 創傷保護剤 |
| 263 化膿性疾患用剤 |
| 264 鎮痛,鎮痒,収斂,消炎剤 |
| 265 寄生性皮ふ疾患用剤 |
| 266 皮ふ軟化剤(腐しょく剤を含む。) |
| 267 毛髪用剤(発毛剤,脱毛剤,染毛剤,養毛剤) |
| 268 浴剤 |
| 269 その他の外皮用薬 |
| 271 歯科用局所麻酔剤 歯科用局所麻酔剤 |
| 272 歯髄失活剤 |
| 273 歯科用鎮痛鎮静剤(根管及び齲窩消毒剤を含む。) |
| 274 歯髄乾屍剤(根管充填剤を含む。) |
| 275 歯髄覆たく剤 |
| 276 歯科用抗生物質製剤 |
| 279 その他の歯科口腔用薬 |
| 290 その他の個々の器官系用医薬品 |
| 311 ビタミンA及びD剤 |
| 312 ビタミンB1剤 |
| 313 ビタミンB剤(ビタミンB1剤を除く。) |
| 314 ビタミンC剤 |
| 315 ビタミンE剤 |
| 316 ビタミンK剤 |
| 317 混合ビタミン剤(ビタミンA・D混合製剤を除く。) |
| 319 その他のビタミン剤 |
| 321 カルシウム剤 |
| 322 無機質製剤 |
| 323 糖類剤 |
| 324 有機酸製剤 |
| 325 たん白アミノ酸製剤 |
| 326 臓器製剤 |
| 327 乳幼児用剤 |
| 329 その他の滋養強壮薬 |
| 331 血液代用剤 |
| 332 止血剤 |
| 333 血液凝固阻止剤 |
| 339 その他の血液・体液用薬 |
| 341 人工腎臓透析用剤 |
| 342 腹膜透析用剤 |
| 349 その他の人工透析用薬 |
| 391 肝臓疾患用剤 |
| 392 解毒剤 |
| 393 習慣性中毒用剤 |
| 394 痛風治療剤 |
| 395 酵素製剤 |
| 396 糖尿病用剤 |
| 397 総合代謝性製剤 |
| 399 他に分類されない代謝性医薬品 |
| 411 クロロフィル製剤 |
| 412 色素製剤 |
| 419 その他の細胞賦活用薬 |
| 421 アルキル化剤 |
| 422 代謝拮抗剤 |
| 423 抗腫瘍性抗生物質製剤 |
| 424 抗腫瘍性植物成分製剤 |
| 429 その他の腫瘍用薬 |
| 430 放射性医薬品 |
| 441 抗ヒスタミン剤 |
| 442 刺激療法剤 |
| 443 非特異性免疫原製剤 |
| 449 その他のアレルギー用薬 |
| 490 その他の組織細胞機能用医薬品 |
| 510 生薬 |
| 520 漢方製剤 |
| 590 その他の生薬及び漢方処方に基づく医薬品 |
| 611 主としてグラム陽性菌に作用するもの |
| 612 主としてグラム陰性菌に作用するもの |
| 613 主としてグラム陽性・陰性菌に作用するもの |
| 614 主としてグラム陽性菌,マイコプラズマに作用するもの |
| 615 主としてグラム陽性・陰性菌,リケッチア,クラミジアに作用するもの |
| 616 主として抗酸菌に作用するもの |
| 617 主としてカビに作用するもの |
| 619 その他の抗生物質製剤(複合抗生物質製剤を含む。) |
| 621 サルファ剤 |
| 622 抗結核剤 |
| 623 抗ハンセン病剤 |
| 624 合成抗菌剤 |
| 625 抗ウイルス剤 |
| 629 その他の化学療法剤 |
| 631 ワクチン類 |
| 632 毒素及びトキソイド類 |
| 633 抗毒素類及び抗レプトスピラ血清類 |
| 634 血液製剤類 |
| 635 生物学的試験用製剤類 |
| 636 混合生物学的製剤 |
| 639 その他の生物学的製剤 |
| 641 抗原虫剤 |
| 642 駆虫剤 |
| 649 その他の寄生動物用薬 |
| 690 その他の病原生物に対する医薬品 |
| 711 賦形剤 |
| 712 軟膏基剤 |
| 713 溶解剤 |
| 714 矯味,矯臭,着色剤 |
| 715 乳化剤 |
| 719 その他の調剤用薬 |
| 721 X線造影剤 |
| 722 機能検査用試薬 |
| 729 その他の診断用薬(体外診断用医薬品を除く。) |
| 731 防腐剤 |
| 732 防疫用殺菌消毒剤 |
| 733 防虫剤 |
| 734 殺虫剤 |
| 735 殺そ剤 |
| 739 その他の公衆衛生用薬 |
| 741 一般検査用試薬 |
| 742 血液検査用試薬 |
| 743 生化学的検査用試薬 |
| 744 免疫血清学的検査用試薬 |
| 745 細菌学的検査用薬 |
| 746 病理組織検査用薬 |
| 747 体外診断用放射性医薬品 |
| 749 その他の体外診断用医薬品 |
| 791 ばん創こう |
| 799 他に分類されない治療を主目的としない医薬品 |
| 811 あへんアルカロイド系麻薬 |
| 812 コカアルカロイド系製剤 |
| 819 その他のアルカロイド系麻薬(天然麻薬) |
| 821 合成麻薬 |
| 829 その他の非アルカロイド系麻薬 |
| 999 薬効不明 |
レセプト摘要欄(調剤報酬請求書及び調剤報酬明細書に関する事項)
当該患者に抗悪性腫瘍剤を注射している保険医療機関の名称及び当該保険医療機関に情報提供を行った年月日を記載すること。(特定薬剤管理指導加算2)
- 850100372 情報提供を行った年月日(特定薬剤管理指導加算2);(元号)yy“年”mm“月”dd“日”
- 830100445 患者に抗悪性腫瘍剤を注射している保険医療機関名(特定薬剤管理指導加算2);******
(医薬品の供給の状況を踏まえ説明を行った場合)
調剤に必要な数量が確保できなかった薬剤名を記載すること。(特定薬剤管理指導加算3ロ)
- 830100910 調剤に必要な数量が確保できなかった薬剤名(特定薬剤管理指導加算3);******
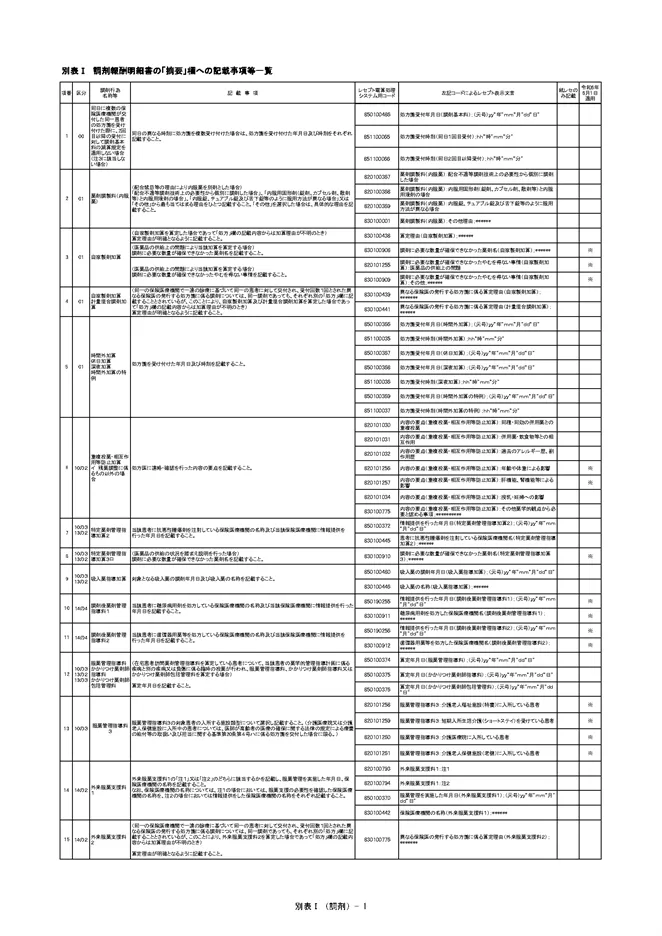
※通知には記載されていないが、地域によっては摘要欄へのコメント不足で返戻になっているようです。返戻対策として、流通不安定の薬以外の場合でも記載しておいてもよいかもしれません。
- 3-イ:RMP・・・RMP対象薬剤名
- 3-ロ:選定療養・・・選定療養について説明
特定薬剤管理指導加算について(関東信越厚生局集団指導資料より)
- 「特に安全管理が必要な医薬品」の指導について
①処方箋受付の際、特に安全管理が必要な薬(ハイリスク薬)について患者の服薬状況、効果の発現状況、注意すべき副作用に係る自覚症状の有無及び当該症状の状況を情報収集し、過去の薬剤服用歴を参照の上、服用に際しての注意すべき事項及び保管に係る取扱い上の注意等を患者及び家族等に指導を行い、薬歴簿に記載して残すこと。
②ハイリスク薬に関し、薬学的管理指導を行う上で必要な情報を事前に情報収集することが望ましいが、薬局で得ることが困難な診療上の収集(例えば臨床検査値など)は必ずしも必要としない。これまでの指導内容を踏まえた適切な指導で良い。 - 「特に安全管理が必要な医薬品」の範囲について
複数の適応を有する医薬品で対象範囲とされている適応以外の目的で使用されていると疑われる場合は処方医等に確認すること。 - 複数のハイリスク薬が処方されている場合の対応
処方されているハイリスク薬のすべての保険薬剤師が必要と認める指導を行うことが要件であり、一部のみのハイリスク薬の指導での算定は認められない。
以下不適切な例
- 処方箋に複数のハイリスク薬の処方で、1調剤ごとに特定薬剤管理指導加算は算定できない。
- 処方箋受付1回につき1回の加算であり1調剤毎の加算ではない
- 特定薬剤管理指導加算の対象とならない薬剤を算定している。
- 免疫抑制剤(リドーラ錠、メタルカプターゼカプセル、アザルフィジンEN腸溶錠、カルフェニール錠、リマチル錠、モーバー錠)
- 血液凝固阻止剤(エパデール、アンプラーグ、ドルナー、オパルモン)
- メネシット配合錠(抗精神用剤は薬効分類117のみであり、抗パーキンソン剤は対象とならない)
- プロスタール錠25(1日1回朝食後)・・・前立腺肥大症は1回25mg1日2回食後、前立腺がんは1回50mg1日2回食後(症状により適宜増減)。プロスタール錠25mgの使用に対しては前立腺がんの適応であるかは処方医に確認すること。(医科レセは前立腺肥大症)
- ビソプロロール等β遮断薬の不整脈ではなく、高血圧への投与
- SGLT2阻害薬の糖尿病ではなく、心不全や腎不全への投与
同時算定の可否
- 特管1-イ・・・ハイリスク薬が新たに追加で算定(10点)
- 特管1-ロ・・・ハイリスク薬の用法用量変更、薬剤師の判断で算定(5点)
- 特管2・・・悪性腫瘍の薬剤の投薬と電話フォロー(100点)
- 特管3-イ・・・RMP(削除はこちらでその都度確認)or安全性情報説明(最初に処方された1回or継続であって初算定のみ)(5点)
- 特管3-ロ・・・選定療養先発説明or供給不安定(最初に処方された1回or継続であって初算定のみ)(
5点→10点)
注 RMPは突然終了する場合(例:デベルザ:R6.6終了)がありますが、下記の例はそのまま修正しませんのであしからず。
| 特管1-イ | 特管1-ロ | 特管2 | 特管3-イ | 特管3-ロ | |
|---|---|---|---|---|---|
| 特管1-イ※1 | × ※3 | × ※4 | △ ※5 | 〇 | 〇 |
| 特管1-ロ※2 | × ※4 | × ※3 | △ ※5 | 〇 | 〇 |
| 特管2 | △ ※5 | △ ※5 | × | 〇 | 〇 |
| 特管3-イ※6 | 〇 | 〇 | 〇 | ×※9 | 〇※7※8 |
| 特管3-ロ※6※10 | 〇 | 〇 | 〇 | 〇※7※8 | ×※9 |
- ※1 特管1-イは、継続して使用している医薬品の場合は、初回であっても算定不可(A薬局でジャヌビア→転院→B薬局でもジャヌビア→B薬局で算定不可)。
また、同一成分の異なる銘柄の医薬品に変更された場合は算定不可(シロスタゾール「サワイ」→シロスタゾール「トーワ」)、(バイアスピリン+ランソ→タケルダ)、(ジャディアンス、トラゼンタ→トラディアンス)→これらの場合は特管1-ロなら算定可。ジャディアンス、ネシーナ→トラディアンスの場合は可
特管3と違い、以前服用していた場合でも、再度新たに追加されれば算定可能。 - ※2 特管1-ロは、用法又は用量の変更がなくても、薬剤師が必要と認めれば算定可能(Doでも必要なら可能)
- ※3 特管1-イ又は特管1-ロは、対象となる医薬品が複数処方されている場合でも、処方箋の受付1回につき1回に限り算定する(ジャヌビアとジャディアンスが新規で出ていても10点のみ、ジャヌビア50→25とジャディアンス25→10でも5点のみ)。
- ※4 特管1-イ又は特管1-ロは、対象となる医薬品が複数処方されている場合、特管1-イ及び特管1-ロをそれぞれ算定することは出来ない。特管1-イ及び特管1-ロのいずれにも該当する場合であっても、重複して算定することはできない(ジャヌビア新規、ジャディアンス25→10でも10点ないし5点のみ)。
- ※5 特管2の算定に係る悪性腫瘍剤及び制吐剤等の支持療法に係る薬剤以外の薬剤を対象として特管1を行った場合のみ併算定可能
- ※6 特管3-イ又は特管3-ロは、継続して使用している医薬品であっても保険薬剤師が必要と認めれば、初回に限り算定は可能(最初に処方された1回に限り算定できるの例外(QA参照))
1、他薬局からの継続- A薬局でデベルザ→転院→B薬局でもデベルザ→B薬局でRMP資材説明で算定可
- A薬局でカルボサワイ→カルボトーワ→転院→B薬局でカルボ杏林→杏林は入らず→カルボトーワは算定可
- 自薬局で継続してデベルザを服用中→デベルザで一度もRMP資材説明を行っていなければ算定可
- 自薬局で継続してラミクタールを服用中→突如ブルーレーターが発出され説明→算定可
- 自薬局で継続してノルバスクを服用中→アムロジピンへの変更を説明→初回なら算定可
- 自薬局で継続してカルボサワイを服用中(以前カルボトーワ使用経験有)→出荷調整で入らずカルボトーワに変更→初回なら算定可
特管3イとロは、同一成分の異なる医薬品への変更は不可とされていないため、ジャディアンス+トラゼンタ→トラディアンスでも再度RMPは算定可能。ジャディアンス10→25のような規格違いやジェネリックのメーカー違いも算定可能ということになるが、常識の範囲内で算定することが望ましいと考える。個人的見解は以下、- 特管3イ(RMP)・・・ジャディアンス10→25では同じRMP資料を使っているため不可
- 特管3イ(安全性情報)・・・安全性情報自体が医薬品に対して発出されることから規格変更で再度算定は不可
- 特管3ロ(選定療養)・・・ムコダイン250→500変更で再度説明すれば算定可能という認識。アマリール0.5と1が同時に処方されていて、0.5で1回、次回1で2回という算定は不可という認識。
- 特管3ロ(供給不安定)・・・ムコダイン250で算定したことがあっても、ムコダイン500で再度算定できるという認識。ムコダイン250「サワイ」の供給不安定でムコダイン500「サワイ」を半錠で出した場合は特管3ロは算定できるが、自家製剤加算は厳しいという認識。
- ※7 特管3-イ及び特管3-ロを満たす医薬品が1回の処方で同時に処方されている場合、特管3-イ及び特管3-ロをそれぞれ算定可能(デベルザ新規+カルボ杏林からカルボトーワは、2×5点+特管1-イの10点)。
- ※8 特管3-イ又は特管3-ロを同時に満たす1つの医薬品が処方されている場合、特管3-イ及び特管3-ロをそれぞれ算定可能(ノボラピッドが供給不安定でフィアスプに変更→RMPで5点、供給不安定で5点、加えて特管1-イの10点)
- ※9 対象となる医薬品が複数処方されている場合に、処方箋受付1回につき、(特管3-イ、特管3-ロ)それぞれ1回に限り算定可能(RMP資材のあるロコアとジャディアンス同時新規処方でも特管3-イは1回だけ)。また、複数の項目(特管3-イの2つの項目&特管3-ロの2つの項目)に該当する場合(特管3-イなら、RMP&安全性情報に該当する)であっても重複して算定することが出来ない
- ※10 特管3-ロの選定療養の説明は、10/1以前であっても算定可能。説明の結果引き続き先発医薬品で継続することになっても算定は可能
特管3ロ(選定療養)は選定療養対象外の公害医療では算定できない。
特管3-ロの供給不安定は、「前回からの銘柄の変更」となっている上に、レセコメに「調剤に必要な数量が確保できなかった薬剤名」を記載する必要があるため、初回受付のGE希望患者に先発を調剤せざるを得ない場合は算定できないと考える(下記コメ2791-2792)
Q&A(新型コロナへの対応)
Q&A(R6年度調剤報酬改定)
(答)算定可能。
(答)本制度に関し、調剤前に医薬品の選択に係る情報が特に必要な患者に対し、当該患者が求める情報について必要かつ十分な説明を行えば算定することができる。
なお、本制度に関する運用上の取扱い(患者が支払う額の具体的な計算方法等)については今後更に周知する予定であるので留意されたい。
(答)特定薬剤管理指導加算1はハイリスク薬に係る処方に対して評価するものであり、1回の処方で「イ」又は「ロ」に該当する複数の医薬品が存在し、それぞれについて必要な指導を行った場合であっても、「イ」又は「ロ」のみ算定すること。
① 患者としては継続して使用している医薬品ではあるが、当該薬局において初めて患者の処方を受け付けた場合
② 同一成分の異なる銘柄の医薬品に変更された場合
(答)いずれもそのとおり。なお、いずれの場合においても、保険薬剤師が必要と認めて指導を行った場合には、要件をみたせば特定薬剤管理指導加算1の「ロ」が算定可能。
(答)特定薬剤管理指導料3の「イ」及び「ロ」は算定できる対象が異なることから、必要事項を満たした説明を行うのであれば算定可能。
(答)当該事例が生じることは想定されないが、それぞれの観点で必要な説明をしているのであれば算定可能。
(答)患者向けRMP資材の薬剤服用歴等への添付及び資材の名称等の記載は不要であるが、指導の要点を薬剤服用歴等に記載すること。
(答)いずれの場合も算定不可。RMP提出品目及び資材については、医薬品医療機器総合機構のウェブサイトにて最新の情報を確認した上で指導をすること。
(https://www.pmda.go.jp/safety/info-services/drugs/itemsinformation/rmp/0001.html)
(答)可能である。
Q&A(R4年度調剤報酬改定)
(答)特定薬剤管理指導加算1と同一月内での算定は不可。なお、特定薬剤管理指導加算1の算定に係る薬剤以外の抗悪性腫瘍剤及び制吐剤等の支持療法に係る薬剤を対象として、特定薬剤管理指導加算2に係る業務を行った場合は、次回の服薬管理指導料の算定時に、特定薬剤管理指導加算2の算定要件を満たせば算定可。
(答)特定薬剤管理指導加算2と同一月内での算定は不可。なお、特定薬剤管理指導加算2の算定に係る抗悪性腫瘍剤及び制吐剤等の支持療法に係る薬剤以外の薬剤を対象として、特定薬剤管理指導加算1に係る業務を行い、算定要件を満たせば算定可。
Q&A(R2年度調剤報酬改定)
(答)特定薬剤管理指導加算2の算定に係る悪性腫瘍剤及び制吐剤等の支持療法に係る薬剤以外の薬剤を対象として、特定薬剤管理指導加算1に係る業務を行った場合は併算定ができる。
(答)算定できない。
(答)保険医療機関に対して情報提供を行い、その後に患者が処方箋を持参した時である。
この場合において、当該処方箋は、当該加算に関連する薬剤を処方した保険医療機関である必要はない。なお、この考え方は、調剤後薬剤管理指導加算においても同様である。
(答)少なくともリアルタイムの音声通話による確認が必要であり、メール又はチャット等による確認は認められない。なお、電話等による患者への確認に加え、メール又はチャット等を補助的に活用することは差し支えない。
(答)当該施設基準の届出時点で、届出日から1年以内に当該研修会等を開催することが決まっている場合については、「当該保険医療機関において外来化学療法に関わる職員及び地域の保険薬局に勤務する薬剤師等を対象とした研修会等を年1回以上実施すること。」の要件を満たしているものとしてよい。なお、届出時に研修会等の開催予定日が分かる書類を添付すること。
Q&A(H28年調剤報酬改定)
(答)貴見のとおり。
なお、対象薬剤の一覧については、厚生労働省のホームページに掲載している。
https://www.iryohoken.go.jp/shinryohoshu/
Q&A(H22年調剤報酬改定)
A.そのとおり。
① 「抗悪性腫瘍剤」には、薬効分類上の「腫瘍用薬」が該当するほか、それ以外の薬効分類に属する医薬品であって悪性腫瘍に対する効能を有するものについて、当該目的で処方された場合が含まれる。
② 「不整脈用剤」には、薬効分類上の「不整脈用剤」が該当するほか、それ以外の薬効分類に属する医薬品であって不整脈に対する効能を有するものについて、当該目的で処方された場合が含まれる。
③ 「抗てんかん剤」には、薬効分類上の「抗てんかん剤」が該当するほか、それ以外の薬効分類に属する医薬品であっててんかんに対する効能を有するものについて、当該目的で処方された場合が含まれる。
A.いずれもそのとおり。
① 薬効分類245「副腎ホルモン剤」に属する副腎皮質ステロイドの内服薬、注射薬及び外用薬は含まれるが、副腎皮質ステロイドの外用薬のうち、その他の薬効分類(131「眼科用剤」、132「耳鼻科用剤」、225「気管支拡張剤」、264「鎮痛、鎮痒、収斂、消炎剤」等)に属するものについては含まれない。
② 関節リウマチの治療に用いられる薬剤のうち、メトトレキサート、ミゾリビン、レフルノミド、インフリキシマブ(遺伝子組換え)、エタネルセプト(遺伝子組換え)、アダリムマブ(遺伝子組換え)及びトシリズマブ(遺伝子組換え)は含まれるが、金チオリンゴ酸ナトリウム、オーラノフィン、D-ペニシラミン、サラゾスルファピリジン、ブシラミン、ロベンザリット二ナトリウム及びアクタリットは含まれない。
③ 移植における拒絶反応の抑制等に用いられるバシリキシマブ(遺伝子組換え)、ムロモナブ-CD3、アザチオプリン、エベロリムス、塩酸グスペリムス、タクロリムス水和物、シクロスポリン及びミコフェノール酸モフェチルは含まれる。
A.そのとおり。
A.そのとおり。薬効分類117「精神神経用剤」に属する医薬品のみが対象となる。
A.そのとおり。
A.差し支えない。
A.特定薬剤管理指導加算の対象範囲以外の目的で使用されている場合には、同加算の算定は認められない。
Q&A(H20年調剤報酬改定)
① 「抗悪性腫瘍剤」には、薬効分類上の腫瘍用薬のほか、インターフェロン、酢酸リュープロレリン等の悪性腫瘍に対する効能を有する薬剤が含まれる。
② 「免疫抑制剤」には、副腎皮質ステロイドの内服薬及び注射薬も含まれる。
③ 「血液凝固阻止剤」には、血液凝固阻止目的で長期間服用するアスピリンは含まれるが、イコサペント酸エチル、ベラプロストナトリウム、塩酸サルポグレラート及び鎮痛・解熱を目的として投与されるアスピリンは対象外である。
A.そのとおり
※イコサペント酸エチル(主な商品名:エパデールなど)
ベラプロストナトリウム(主な商品名:ドルナー、プロサイリンなど)
塩酸サルポグレラート(主な商品名:アンプラーグなど)
A.薬効分類117に属する「精神神経用剤」のみが対象であり、薬効分類112に属する「催眠鎮静剤、抗不安剤」は含まれない。
A.そのとおり。
※メトトレキサート(主な商品名:リウマトレックスなど)
ミゾリビン(主な商品名:ブレディニン)
レフルノミド(主な商品名:アラバ)
金チオリンゴ酸ナトリウム(主な商品名:シオゾール注)
オーラノフィン(主な商品名:リドーラなど)
D-ペニシラミン(主な商品名:メタルカプターゼ)
サラゾスルファピリジン(主な商品名:アザルフィジンENなど)
ブシラミン(主な商品名:リマチルなど)
ロベンザリット二ナトリウム(主な商品名:カルフェニール)
アクタリット(主な商品名:モーバー、オークル)
Q&A(群馬県 社会保険委員会Q&Aより)
A:このように適応外で使用する場合は算定の対象にならないと思われる。
A:認められておりません。1枚の処方箋でハイリスク薬が2種類以上処方されている場合は、「すべてについて必要な薬学的管理および指導を行うこと」となります。
コメントor補足情報orご指摘あればをお願いします。
記事No3030 題名:Re:じゅう様 投稿者:管理人tera 投稿日:2025-08-06 16:07:17
個人的見解は補足にも記載した通り、お薬手帳なり、薬歴なり、過去の処方入力履歴なりで過去の薬剤を確認でき、同じ内容のハイリスク薬が処方されていれば5点、異なるハイリスク薬に変更なっていれば10点かと思います。
しかし、あまりに久々、例えば2年前にグラクティブ、久々に受診し、またグラクティブの時は、継続ではないと判断し、新たにとして10点を算定してしまってもよいと思います。
記事No3029 題名:特定薬剤管理指導1について 投稿者:じゅう 投稿日:2025-08-04 19:56:53
特定薬剤管理指導加算1は「新たに」処方された場合、用法用量変更薬剤師の判断で、5点10点と変わりますが、久しぶりにハイリスク薬が処方された場合は新たに、でとれると思いますか?
お薬手帳なり、薬歴なり、過去の処方入力履歴なりで確認できたら5点なのでは?と個人的には思うのですが薬局内で意見が割れてしまってます
記事No2971 題名:Re:レルミナ様 投稿者:管理人tera 投稿日:2025-04-12 17:12:20
確認が漏れてしまってだいぶ遅くなってしまい申し訳ないです。
患者さんがジェネリック希望ですし、薬局の備蓄で選定療養は発生しないので、加算は算定できないと思います。
記事No2958 題名:特定薬剤管理指導 投稿者:レルミナ 投稿日:2025-03-26 09:43:09
新規患者でジェネリック希望だったが、薬局の備蓄が先発しかなかった場合、特定薬剤管理指導3の加算は可能でしょうか
記事No2957 題名:Re:バジリスク様 投稿者:管理人tera 投稿日:2025-03-25 08:19:32
今回処方の薬に対して選定療養の対象となる先発品(長期収載品)を希望しているのであれば、説明を行うことにより点数は算定できます。
過去にGE希望であったかどうかは気にしなくてよいと思います。
- << 前のページ
- 次のページ >>


