界面活性剤
界面活性剤は親油基と親水基で構成されていて、二つの極性の基を持つことで、油も水もどちらも吸着することができます。
下の図を見ていただければ分かるとおり、界面活性剤が親水基を外側に、油汚れがくっついた親油基を内側にしてミセルを形成することで水の中に油分を均等に配分する、つまり溶かす事ができます。
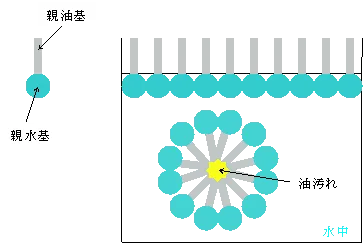
このように、界面活性剤の主な役割は相互に反発しあう液体と液体溶解させることですが、他にも幾つかの作用があります。(参考イメージ:界面活性剤って)
- 湿潤作用・浸透作用・・・水に浮いている大きな個体(葉っぱ等)が界面活性剤により水中に落ちる
- 分散作用・・・水に浮いている細かい固体(きなことか)が界面活性剤により水中に分散する
- 乳化作用・・・油と水(お互い液体)が界面活性剤により水中で混ざり合う=エマルション
- 気泡作用・・・空気と水(気体と液体)が界面活性剤で水の膜の中に空気を取り込むようになる
- 洗浄作用・・・界面活性剤の疎水基が油汚れに吸着し、ミセルを形成して汚れを取り除く
乳化は界面活性作用の中の一部(液体と液体)であるので、乳化剤は界面活性剤に比べると限定的な作用を担う。
界面活性剤の種類
界面活性剤にイオン型と非イオン型に大きく分けることができます。
イオン性界面活性剤
| 型 | 特徴 | 例 |
| 陽イオン | 水に溶かすと解離して界面活性作用を持つ部分が陽イオン | 逆性石鹸 |
| 陰イオン | 水に溶かすと解離して界面活性作用を持つ部分が陰イオン | 石鹸 (ラウリル硫酸Na、 アルキルベンゼンスルホン酸) |
| 両性 | 溶液がアルカリ性で陰イオン、酸性で陽イオン |
非イオン性界面活性剤
水中で解離しないで-OH基や-O-結合などが親水基、アルキル基が親油基となっているもの(ラウロマクロゴール、Tween系など)。
界面活性剤の性質
1、cmc
液体に界面活性剤を少しずつ入れていくと、界面or表面に凝縮膜(単分子膜)を作り始めます。これは界面活性剤の親油基、親水基のうちその液体に溶けることのできない基(上図でいうと親油基)が液体から逃げようと液面から顔を出して並ぶことで、さらに加えていくことで表面が覆い尽くされると、逃げ場を失った基(図でいう親油基)が油汚れなどがなかったとしても、ミセルを形成し液体に溶ける。このときの温度をcmc(ミセルを形成し始める臨界濃度)と呼ぶ。
2、クラフト点(Kp)
イオン性界面活性剤の水に対する溶解度が、急激に上昇する温度のこと。
一般に、イオン性界面活性剤のアルキル鎖が長くなるとクラフト点は上がりcmcは下がる。
3、曇点
非イオン性界面活性剤の液体を加温していくと、やがて水素結合が切れて溶解度が急激に減少する。このときの温度を曇点と呼び、曇点
以下の温度でないとミセルは形成しない。つまり、ヒルドイドなどを高温にさらすとヘパリン類似物質の溶解度が急激に下がると言うこと。
界面活性剤のHLB
HLB(親水親油平衡)とは、親水基と親油基のバランスを示す値で、0~20の数値で表され、その値は、【HLB=7+Σ(親水基の個数)-Σ(親油基の個数)】 で計算されます。最も親水性のものは20、最も親油性のものは1、中間は7という具合です。
エマルション(乳剤)と型
エマルションというのは、界面活性剤の働きにより液体が液体に溶けている状態のことを指します。親水性の液体が親油性の液体 に溶けている場合のことをw/o型(water in oil)と呼び、逆をo/w型(oil in water)と呼んでいます。油が水に溶けるか、水が油に 溶けるかで剤質はまったく変わります。
例えば、サラダ油2ml、醤油5mlのドレッシングがあったとします。親水性である醤油の方が明らかに多いので、通常であればHLB7以上 の界面活性剤を加えて乳化させます。親水基の多い界面活性剤のほうが醤油の中では安定だからです。
最後に、転相について説明します。o/w型の乳剤に油を加えると、粘度が上昇していき、内相であるoilの濃度があがっていきます。 そして74.02%を超えたとき内相と外相が逆転し、o/w型からw/o型へと変わります。この変化のことを転相と呼びます。
- CD
- 樹状細胞
- NK細胞
- リバウンド
- B細胞
- キラーT細胞
- 感作
- リンパ球
- アラキドン酸カスケード
- Igの構造
- サイトカイン
- ニューロペプチド
- セラミド
- 界面活性剤
- 好酸球
- ケモカイン
- インテグリン
- レギュレーターリスト
- 色素沈着
- 成長因子(GF)
- 活性酸素(ROS)
- NF-κB
- アレルギーの種類
- 骨代謝
- 抗菌ペプチド
- ヘルパーT細胞
- 好塩基球
- 血液凝固反応
- テオフィリン・β刺激薬の抗炎症作用
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


