光毒性反応と光アレルギー反応
NSAIDsなどの光学過敏を起こしやすい薬剤は、その化学構造の中にクロモフォア(chromophore:発色団)と呼ばれUVA/UVBなどの紫外線を吸収する一群の原子団が存在します。
クロモフォアは紫外線のエネルギーを吸収して励起され、一重項状態(合成スピン0)となりますが、不安定なため、普通はほのかに発光(エネルギーを失って)して直ちに基底状態(三重項状態:合成スピン1)へと戻ります。
しかし、項間交差によって励起三重項状態へと移行する場合があります。
その励起三重項状態のエネルギーレベルが一重項酸素のエネルギーレベルより高い場合は、エネルギー転移を起こして活性酸素の一つである一重項酸素産生され、一重項酸素は細胞膜脂質を酸化して傷害する(TypeⅡ反応)。
また、励起三重項状態が細胞膜脂質などの間で電子を授受することによってフリーラジカルが生成され、それが自細胞を酸化して傷害する(TypeⅠ反応)。
この活性酸素やフリーラジカルによる細胞脂質、タンパク質の傷害を光毒性反応と呼び、これらにより引き起こされた化学反応によって生じた物質(抗原)が 一連の免疫反応を経てアレルギー反応を引き起こすことを光アレルギー反応と呼びます。
量子化学について(適当・・・)
酸化というのは+が増えること、つまり電子が奪われてしまうことを意味します。電子が出てきたついでに量子化学について少し述べてみます。
原子は陽子と電子を持っている。そして、陽子の位置は変わらないが、その一つ一つの電子はそれぞれ自分の波動関数(自分がどう動くのか)を持っていて、その関数が示す軌跡をたどる。
波動関数って言うぐらいだから、陽子の周りを波打ちながら(sin,cosの関数)、ドブロイさんが言う「波の波長λの整数倍が周の長さと等しい」に従い波を崩さないで、まぁそんな感じで自分だけの道をくねくねしながら動いている。
原子同士が反応する際、同じもしくは近い波動関数を持つ電子同士であれば、その波は共鳴し合い反応が起こりやすい。
波動関数は波で振動数を持つため で示されるエネルギーを持つ。そして、そのエネルギー準位別に分けたものが、パウリさんが言った「4つの量子数で定められる1つの量子状態を2個以上の電子が占めることはできない」にのっとった、n(主量子数=K殻、L殻)、l(方位量子数=s、p)、m(磁気量子数=2pxのx)、s(スピン量子数=1つの部屋の矢印の向き)の考えである。
で、電子はエネルギーが低い(安定)な波動関数を選びたがる。言うなれば、安定な波動関数は人気が高いってこと。そこで、電子はエネルギー準位の低いところから順に生めていく。仮に、NとFを反応させたとすると、Fの2pyにいた逆スピンの電子が、Nの2pxに入りたがる。
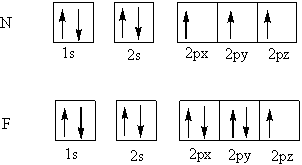
スピンというのは電子、陽子の自転のようなもの(実際は違うらしいが)電荷を持ったものが自転すると磁気が発生する (右ねじの法則だっけ、フレミング?)。電子と陽子は質量差が大きいから遮蔽はするが、陽子の磁場を電子が打ち消すことはない。
と考えると、陽子の磁場は陽子が、電子の磁場は電子が打ち消すことで(打ち消すためにはエネルギーが必要だからフントの法則=始めスピンを揃えて入るがある。)安定状態を保つ。
原子番号が偶数の原子は右回りの自転で生み出した磁場を左回りの磁場で打ち消す(陽子も電子も)から、外から加えられる磁場に(外部磁場)に対して安定だけど、奇数の原子は打ち消すものがないから、反対回りの自転になっても誰もそれを補正してくれない。
エネルギーに着目した2原子(今までは1原子)の反応の起こりやすさを考える。熱力学とは違い(エネルギー準位が違いすぎると電子がたくさん少ない方に移動する、つまり水素が酸素になってしまう、これはムリ)、近いエネルギー準位での反応が最も起こりやすい反応である(水素はたいてい炭素と一緒、エネルギー準位は違うが、混成軌道を作って準位を近くしているから大丈夫)。水素原子の反応を考えてみる。
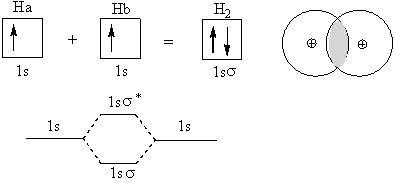
ちょうど磁場が不安定だったところに打ち消してくれる電子が一つきて、いい感じの結合(共有結合)になる。(色が付いた部分は波動方程式からの確率密度が高い部分) ポイントは2つの原子間での反応を考える時、同じ波動関数(同じエネルギー)を持っていたものは2つに分かれること。
今度は水素原子と、水素アニオンについて考えてみると、下図のようになる。

これは、色の付いた部分以外に存在する電子(結合に関係ない電子)が円の外側に位置して、陽子を引っ張ることによる、エネルギー準位の増加(不安定化)。
今度はヘリウム(希ガスで分子を作らない=反応しない)について考える。
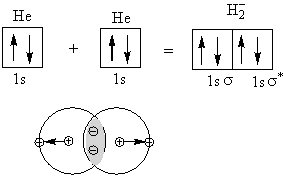
両側の電子が引っ張ることにより完全に解離する。つまり、共有結合というのはオクッテト則(原子の周りの電子数の総和が2(H,He)もしくは、8である)を満足していなくて、エネルギー準位が近いもの同士がするものである。
ここで、σの上についている*は反結合軌道を表し、何も付いていないσは結合軌道を表す。
さて、ここで活性酸素と呼ばれる4つの物質(ヒドロキシラジカル、過酸化水素、一重項酸素、スーパーオキシドアニオン)の元となる三重項酸素について考える。
酸素(O)という元素は二つの不対電子(1つの軌道に1つしか電子が入っていない)を持っているため、もともと不安定な元素である。ちなみに不対電子を一つ持つ元素をラジカルと呼ぶ。
酸素原子同士が結合して酸素分子を作った場合、結合性軌道の2pyπ、2pzπまで埋まった後、反結合性軌道である2pyπ*、2pzπ*に一つずつ電子が入る(パウリより)。
2pyπ*、2pzπ*は共に同じエネルギー準位であるので、反結合性軌道上の2つの電子は、二つの部屋のどちらに入ることもできるし、また2方向のスピンを取れるために、エネルギーを吸収すると容易に基底状態である三重項(↑↑=スピン1)から一重項(↑↓=スピン0)状態へと遷移する。
遷移した後は不安定な状態であるために、もとの発光によりエネルギーを放出して三重項にもどるか、別の部屋に電子を無理やり入れて安定になるかどちらかをとらざるを 得ない。これが相手から電子(-)を奪って(+)にさせるという酸化のメカニズムである。
- 光の種類
- 紫外線の作用機序
- 光線過敏症
-
└ 紫外線療法
├ PUVA療法
├ broad-band UVB療法
├ broad-band UVA療法
├ UVA/UVB混合照射療法
└ narrow-band UVB療法
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


