ツイミーグ(イメグリミン)
| 分類 | 成分名 | 商品名 | 規格・剤形・補足 |
|---|---|---|---|
| グリミン系 | イメグリミン | ツイミーグ | 規格:500mg 適応:2型糖尿病 |
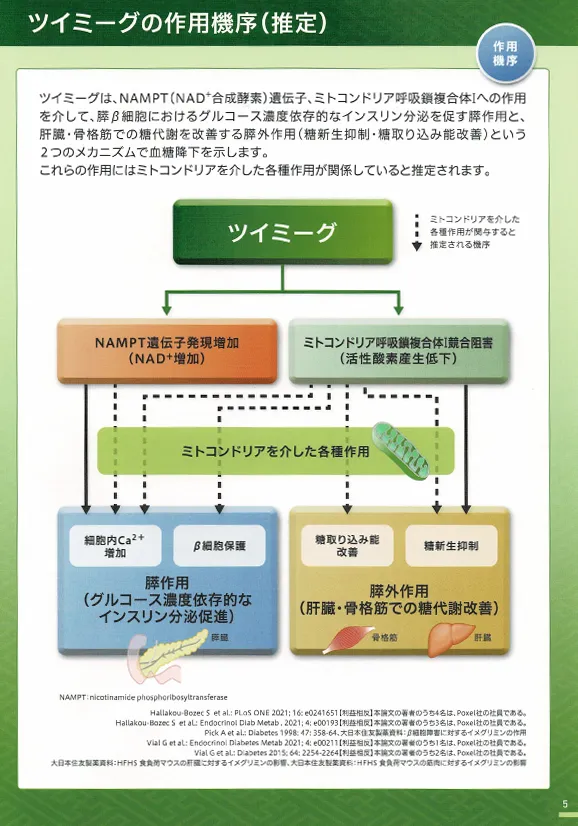
ツイミーグ(イメグリミン)は、インスリン分泌臓器である膵臓、並びにインスリン標的臓器である肝臓、骨格筋等でミトコンドリアへ作用すると想定されており、グルコース濃度依存的なインスリン分泌を促す膵作用と、肝臓・骨格筋での糖代謝を改善する膵外作用(糖新生抑制・糖取込み能改善)を発揮する。
そのため、2 型糖尿病発症の成因がインスリン分泌低下あるいはインスリン抵抗性亢進のいずれであっても血糖降下作用が期待できるとされる(能書より)
ツイミーグ(イメグリミン)の作用機序
能書の薬効薬理とメーカーの販促パンフ上での作用機序は、
- NAMPT遺伝子発現上昇作用による細胞内NAD+増加作用→これによりランゲルハンス島細胞内ATP、Ca2+が増加→グルコース濃度依存的なインスリン分泌作用(膵内作用)
- ミトコンドリア呼吸鎖複合体Ⅰ競合阻害による活性酸素(ROS)産生低下作用→β細胞保護作用(膵内作用)+糖の取り込み改善作用(膵外)+糖新生抑制作用(膵外)
- 膵β細胞量増加作用
- グルコースまたはフルクトースにより誘発される細胞死抑制作用
- 脂質量、TG量、コレステロール量低下作用、
- 筋肉におけるミトコンドリアの生合成に関わる Pgc1a mRNA 発現上昇作用と最大呼吸能上昇作用
となっている。
NAMPT遺伝子の発現上昇
まず、通常のインスリン分泌の機序は、膵β細胞内に取り込まれたグルコースがミトコンドリアでATPに変換され、ATP/ADP比が上昇すると細胞膜上のATP感受性Kチャネルが閉鎖し、K+の流出が減少して細胞膜が脱分極、脱分極により電位依存性Ca2+チャネルが開口し、Ca2+が細胞内に流入しインスリン分泌うが促進するというものである。
これを踏まえて、NAMPT遺伝子(NAD+合成酵素)発現によるNAD+増加(NicotinamideがNAMPTの作用でNMNとなり、NMNがNMNATの作用でNAD+となる)がもたらす効果としては、
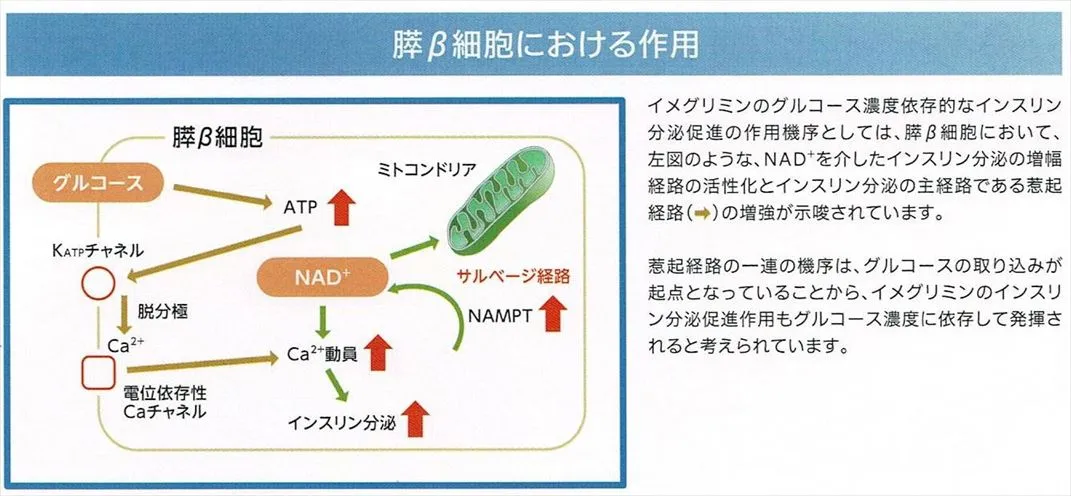
細胞質内でグリセルアルデヒド-3-リン酸→ホスホエノールピルビン酸の経路が動くようになるため、嫌気的条件下と同じように4ATPを生み出せるようになり、結果、ATP依存性K+チャネルの閉口→電位依存性Ca2+チャネル開口→Ca2+放出→インスリン分泌の機序が進む。
また、NAD+は細胞内に存在しているCD38の作用でcADPR(サイクリックADPリボース)を作り出し、cADPRは細胞内の小胞体からCa2+の放出を行うことでインスリンを分泌させる。(細胞外からチャネルを介したCa2+流入とは別経路)
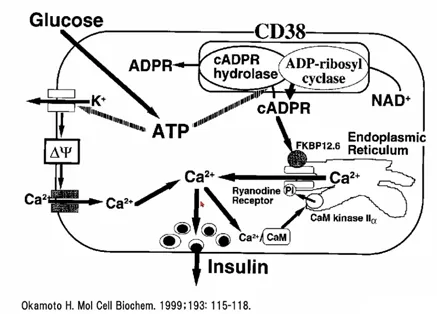
加えて、グルコース濃度依存性orGLP-1受容体を介した作用により開口し、Ca2+とNa+を細胞内に流入させるTRPM2というイオンチャネルによるインスリン分泌の増強作用が知られている。
TRPM2が活性化すると細胞内への電流が増えて弱い脱分極の状態が作られるが、それだけで電位依存性Caチャネルを開口する程の強い脱分極でない。そのため、グルコース及びATPが増加した際に瞬時にK+チャネルの閉鎖及びインスリンぷ分泌を起こさせるような準備状態を作るとされている。
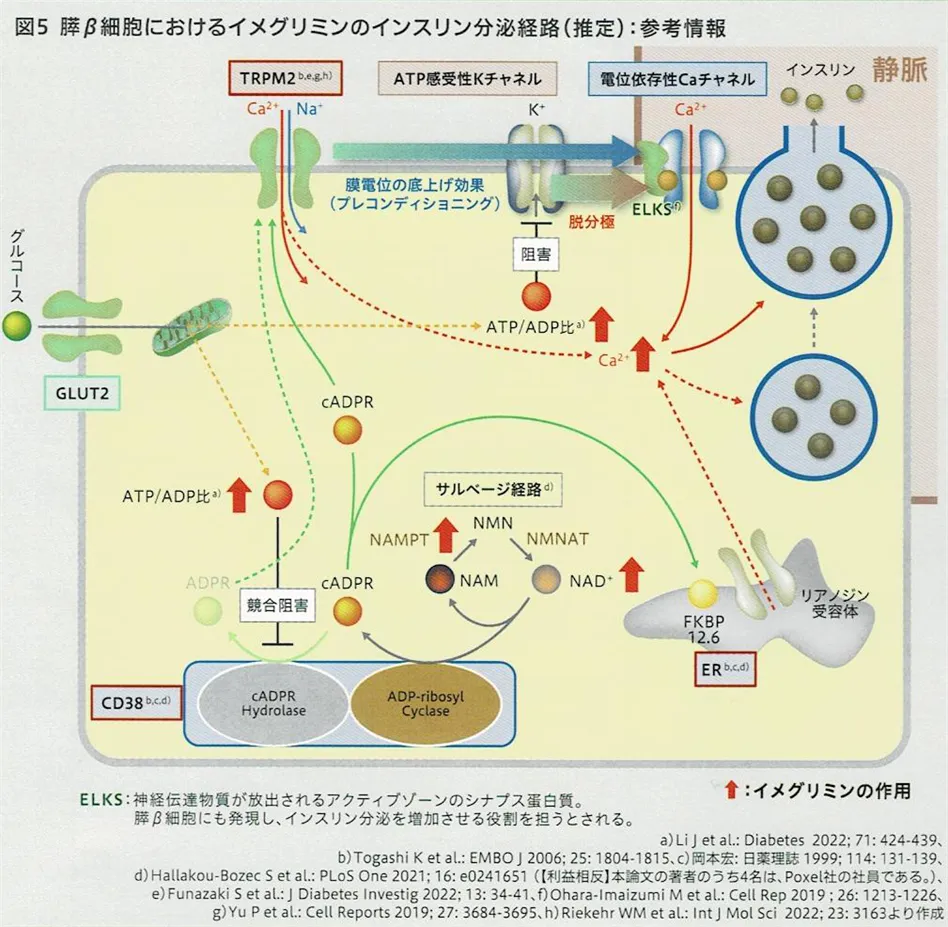
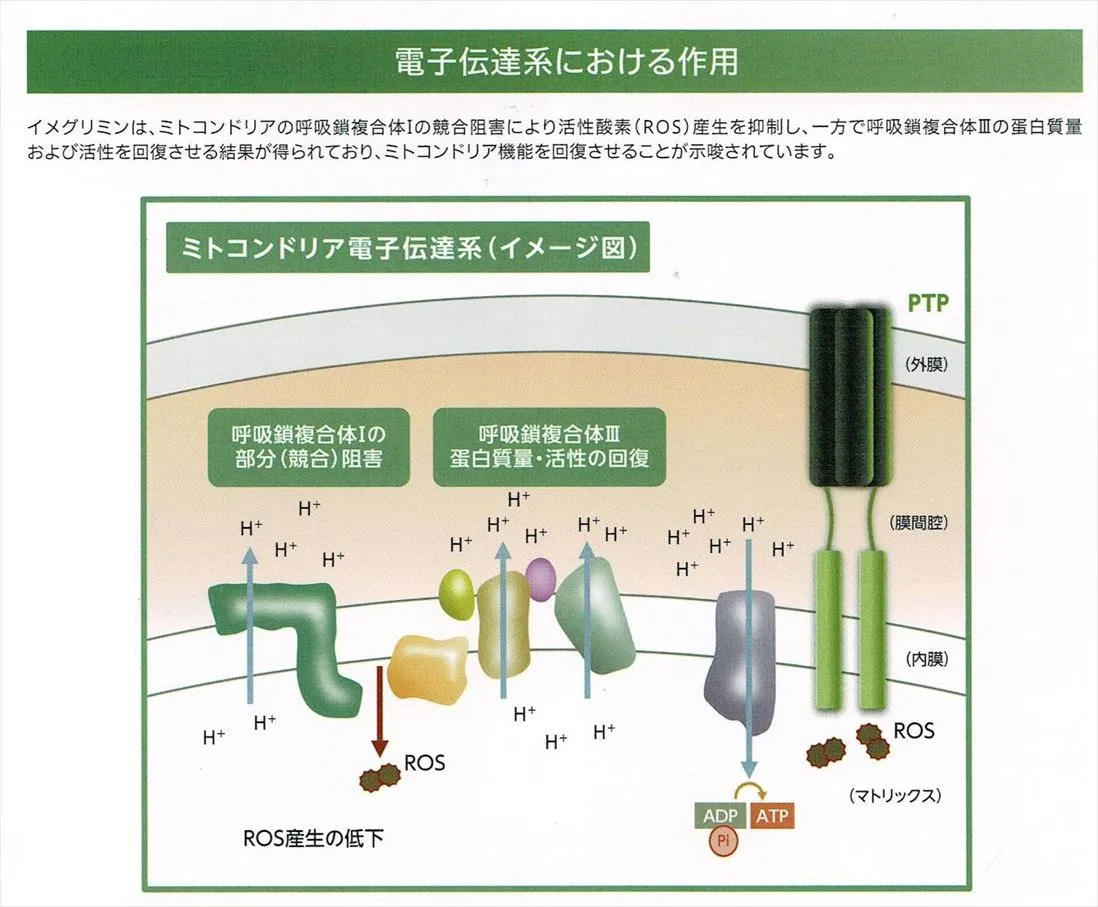
ミトコンドリアの呼吸鎖複合体阻害
ミトコンドリアの呼吸鎖複合体はⅠ~Ⅴまである(電子伝達系参照)が、イメグリミンが作用するのはⅠということで、ⅡとⅢから生み出される活性酸素は低下はさせないという。→イメグリミンは複合体Ⅰを競合的に阻害し複合体Ⅲの活性を促進する。
糖の取り込み改善作用はAMPK活性化からのTBC1D1活性化を介したULT4のトランスロケーション活性化に加えて、活性酸素(ROS)を阻害することで、活性酸素により生み出されるTNF-αによるGULT4のトランスロケーションの抑制作用を阻害する作用も影響していると推測。
活性酸素抑制による糖新生抑制作用は、複合体Ⅰ(NADH-ユビキノン酸化還元酵素)の競合阻害(メトホルミンは基質濃度に関係なく不競合阻害するので酸素消費を低下させやすく乳酸を生じやすい=悪心下痢の頻度がイメグリミンより高い)により、NADHからの電子をユビキノンへ伝達する反応(NADH + ユビキノン → NAD+ + ユビキノール)を抑制し、ATP産生を抑制→AMPK活性化からのHDAC活性化が起こることに起因するとともに、ミトコンドリア内でのNADH→NAD+が進まず、NAD+が不足し、リンゴ酸-アスパラギン酸シャトルを介した細胞質内のNADH→NAD+の反応が進まず、結果、糖新生の主経路(乳酸+NAD+→ピルビン酸+NADH)が進まなくなることが原因と推測する。
こう考えると電子伝達系ではNAD+が少なくなり、細胞質ではNAD+を多くするという相反する作用をしているように見える。これは、事実である一方、膵内ではNAD+を増やす(NAMPT遺伝子の発現上昇)が減らす方(複合体阻害)よりも勝るが、膵外ではNAMPT遺伝子の発現上昇は起こらず、複合体阻害のみの作用でそちらの効果だけが発現すると考える。
膵β細胞量の増加と細胞死抑制等その他作用
膵β細胞量の増加や細胞死抑制は活性酸素の影響なのかな?
ROSやCa2+が増えると、細胞膜のPTP(Permeability Transition Pore:ミトコンドリア膜透過性遷移孔:下画像参照)が開き、ミトコンドリアにアポトーシスを誘導する物質(シトクロムC)を放出するため、ROSを抑制すると膵β細胞の増加や細胞死の抑制が起こると説明される。糖尿病の人はROSが多いのでこれを抑制する効果は高い。
筋肉でのミトコンドリア生合成アップの機序も不明。ミトコンドリアが増えれば呼吸能が上昇するのは当然のお話。
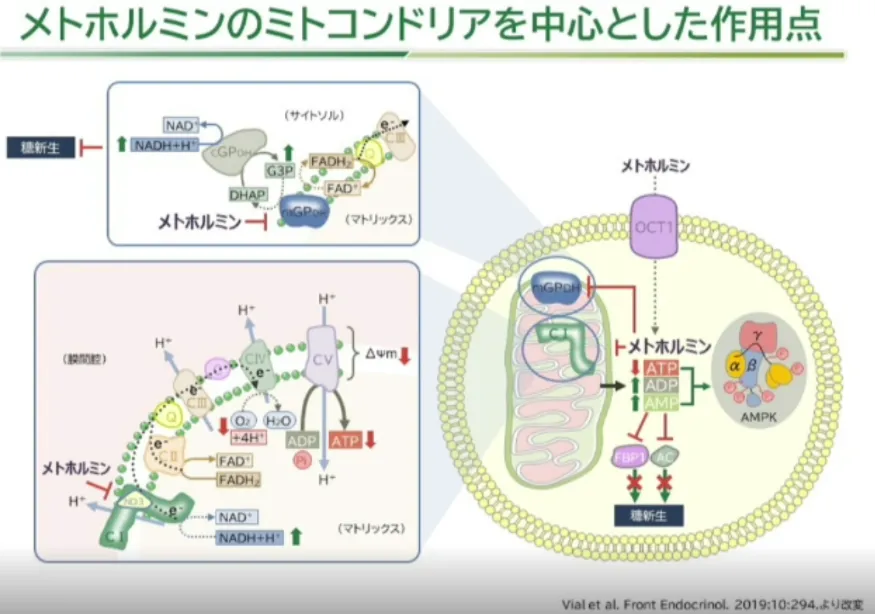
メトホルミンはFAD依存性グリセロール3リン酸デヒドロゲナーゼ(mGPDH)を抑制することで脱水状態時等に乳酸濃度を上昇させるが、ツイミーグはmGPDH抑制作用がないため、乳酸を基質としたATP合成を阻害しないことで乳酸アシドーシスを惹起しずらいと考えられている。とパンフには記載してある。
メトホルミンとイメグリミンの違いを着目すれば、イメグリミンは複合体Ⅲの活性も促進しATP量を大幅に減らさず、複合体Ⅰで失ったNAD+を、膵β細胞でNAD+供給を促進(機序不明)することで補い、乳酸アシドーシスのリスクを減らせる点と、メトホルミンが複合体Ⅰを不競合阻害するのに対して、イメグリミンは競合阻害するため、基質(NADHとユビキノン)が十分にあればATP産生量には影響は与えないという点、メトホルミンの複合体Ⅰ阻害作用ともう一つの作用であるmGPDH阻害作用がイメグリミンにはないので、NAD+不足による乳酸蓄積が起こりにくい点ということになる。
ここまでの機序を踏まえたうえで他剤と比較すると、インスリン分泌作用は結局のところSU剤と機序は同じだけど血糖依存的にインスリンを分泌するとのことでDPP4阻害剤の方が近い。糖新生抑制作用はメトホルミンの複合体Ⅰ阻害機序と同じであるものの機序的に副作用は少なく、骨格筋での糖の取り込み促進作用もメトホルミンと同じと言える。
ツイミーグ(イメグリミン)の適応
対象は、成人で、通常1回1000㎎を1日2回朝夕に服用する。
腎機能障害に対してはメトホルミンと同様、禁忌とされておらず、定期的に検査し、eGFRが45mL/min/1.73㎡未満の患者には推奨されない。
メトホルミン併用についは、禁忌ではないが、併用により消化器症状が悪化しやすくなるため、副作用の発現に注意する。アシドーシスの発現については臨床試験では認められていないが、注意は必要との記載がある。
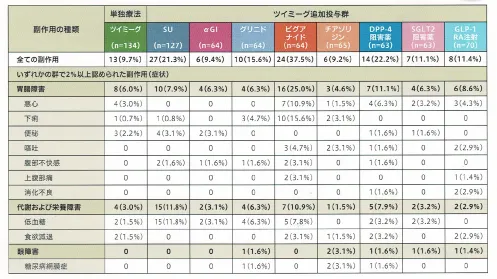
副作用
主なものは低血糖、胃腸障害(悪心・便秘・下痢)。メトホルミンと併用すると胃腸障害のリスクがかなり高くなることがわかる。
メトホルミン単剤と比較した場合は、用量にもよるがメトホルミンのほうがツイミーグより胃腸障害の頻度が高いイメージ。
実際にメトホルミン2000㎎やDPP4合わせて投与したケースでは、やはり比較的高頻度で、めまい(脳梗塞に匹敵するものも含む)、吐き気がでているものの、予期されたほどは出ていない印象(実体験)。
国内第三相臨床試験
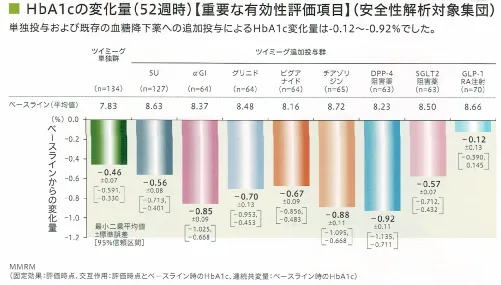
用量設定試験で1回500mg、1000㎎、1500mgの3つで比較したところ、500㎎よりも1000mgの方がHbA1c低下作用が高く、1000と1500mgのHbA1c低下作用にほとんど差がないこと、1000と1500mgで比較したときの副作用発現率に4倍以上の差があることから、1回1000㎎に用量設定された。
HbA1cのベースラインからの変化量は4か月くらいかけてゆっくりと下がってくる。
また、ビグアナイドと併用してもHbA1cを下げてくれるが、GLP-1注射剤と併用したときにHbA1cが下がらない理由は不明。
糖尿病の薬の種類
- インスリン製剤
- GLP-1受容体作動薬
- SU剤(スルホニルウレア剤)
- グリニド剤(速効型インスリン分泌促進薬)
- ビグアナイド系
- チアゾリジン系
- α-グルコシダーゼ阻害薬
- DPP4阻害薬
- SGLT2阻害薬
- 糖尿病性神経症治療薬
- 糖尿病性腎症治療薬
- 配合剤
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


