アラキドン酸カスケード
アラキドン酸は必須脂肪酸であるリノール酸から生合成される脂肪酸で、細胞膜のリン脂質の成分です(ホスファチジルコリン=レシチンを構成する2つの脂肪酸のうちの一つ)。
カスケードは”滝”の意味で、アラキドン酸カスケードとはアラキドン酸という出発点から滝のように進行することを意味します。
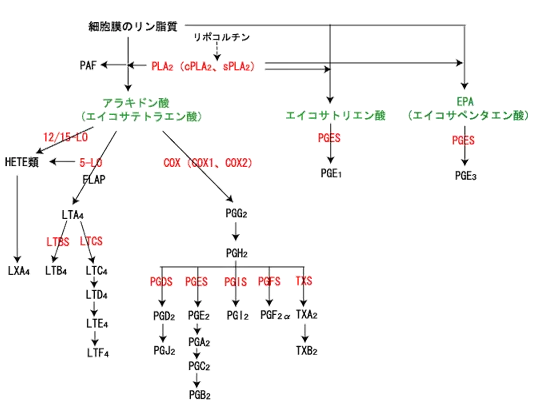
ホスホリパーゼA2(PLA2)の活性化
数々の炎症反応が起こると、細胞内Ca2+の上昇とMAPKによるリン酸化に呼応し、ホスホリパーゼA2(PLA2)という酵素が活性化される。
MAPKカスケードの下図参照
PLA2にはいくつかのサブタイプが存在するが、そのうちアレルギーとかかわりが深いといわれるのは、細胞質型PLA2(cPLA2α)と分泌性PLA2(sPLA2)群である。cPLA2αはほとんどすべての細胞に、sPLA2は主にマスト細胞に発現していて、共にLTとPG産生に関与している(現在のところはくわしくはわかっていない)。
ホスホリパーゼA2は 肥満細胞、血小板などの細胞膜のリン脂質(ホスホリピド)からアラキドン酸を遊離させます。このアラキドン酸が、ミクロソーム酵素のシクロオキシゲナーゼ(COX)と5-リポキシゲナーゼ(5-LO)、12/15-LOの作用により分岐してリポキシン(LX)類とLT(ロイコトリエン)類とPG(プロスタグランジン)類が産生されます。
LT類
5-LOはアラキドン酸提示分子であるFLAPの介在下、アラキドン酸をLTA4に変換する。 LTA4は、LTBS(LTB4合成酵素=LTA4ハイドロラーゼ)とLTCS(LTC4合成酵素=グルタチオンSトランスフェラーゼ)の作用でLTB4とLTC4に分岐する。
LTC4は組織中で容易にLTD4、LTE4に変換され、同一受容体に作用するのでLTC4、LTD4、LTE4をまとめて、CysLT(cysteinyl LT)と総称される。
CysLTの受容体にはCysLT1とCysLT2が存在し、CysLT1を刺激すると、脱顆粒やエイコサノイドの産生を伴わずに、IL-5、TNF-αらのサイトカインの発現が亢進する。 また、内在LTC4はCysLT1を介してサイトカイン産生を増幅する役割を持つという。
CysLT2を刺激すると、IL-8などのケモカイン産生が誘導される。
皮膚アレルギーでは、CysLT1/2両受容体はどちらもアレルギー応答を増悪させるが、気道アレルギーにおいては、CysLT1はアレルギー応答を減少させ、逆にCysLT2は増悪させるという、2種の受容体が相反する機能を持つ。
LTB4の受容体にはLTB4特異性が高いBLT1と他のエイコサノイドとも結合しうる低親和性のBLT2が存在し、主にBLT1を介してマスト細胞前駆細胞やT細胞の遊走の促進、Th2応答の増強に関わる。
| LTB4 | 白血球遊走、活性酸素産生、脱顆粒促進、NK細胞活性化 |
| LTC4、LTD4 | 気管支収縮、血管透過性亢進 |
LTは好酸球からも肥満細胞からも遊離されるが、PGは好酸球からは遊離されない。
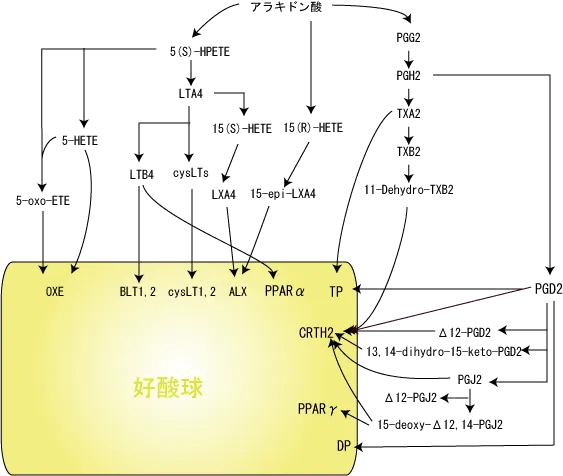
アラキドン酸から5-LOと12/15-LOの協調作用により5-HPETE(5-ヒドロペルオキシエイコサテトラエン酸)を経て 産生されるLXA2はCysLT受容体を競合的に阻害するほか、LXA2受容体(ALX)へ結合し、主に好中球・好酸球の細胞遊走抑制、CD11b発現抑制による細胞接着の阻害など、総合的にアレルギーを抑制する。
NADPHオキシダーゼ活性化や酸化ストレスの存在下で5-HPETEから生じる中間体5-oxo-エイコサテトラエン酸(ETE)は、その受容体OXE(7回膜貫通型受容体、Gi蛋白共役型)に作用して、血小板活性化因子と比べて10倍強力な好酸球遊走因子として作用すると同時に、CD11b発現亢進、脱顆粒促進作用も示す。皮下投与により強力な好酸球集積作用を示す。
PG類
COXは、常在型のCOX1と炎症によって誘導されるCOX2に分けられ、これらはアラキドン酸をPGH2へと変換する。
PGD2合成酵素(PGDS)にはL-PGDSとH-PGDSの2つの分子種がある。
L-PGDSはTh2アレルギーを増悪させる。
H-PGDS(造血型PGDS)は転写因子MITFにより直接制御されており、産生されるPGD2はその受容体であるDP1、DP2(CRTH2)に結合し、
DP1・・・リンパ球や好酸球の遊走、Th2サイトカインを上昇と樹状細胞遊走・機能抑制作用という相反する作用を持つと考えられている。
DP2・・・Th2細胞、好酸球の遊走を促進するが、抗アレルギー作用を持つという報告もあり今後の解析が待たれる。
PGD2の非酵素的代謝産物としては、12d-PGD2、12d-PGJ2、13,14-dehydro-15-keto-PGD2、15-deoxy-12d,14-PGJ2(15d-PGJ2)などが知られており、これらは、CRTH2受容体やPPARγ受容体に作用することで、15d-PGJ2は抗炎症作用、12d-PGJ2は好酸球動員作用など数々の作用を引き起こす。
PPARsの作用
PGD2の持つ炎症促進作用が、その代謝産物である15d-PGJ2によって収束される。また、COX2遺伝子の発現がPPARγによって制御される。
低濃度(pMレベル)の15d-PGJ2は、エオタキシンに対する好酸球遊走にプライミング効果を有している。これには、PPARγの結合を介するものの転写は利用しないnongenomicな機序が関与しており、PPARγは核内移行せずに細胞質においてCa2+シグナルを増強する。
また、μMレベルの比較的高濃度のPPARγは、逆に遊走の抑制に働く。
15d-PGJ2のPPARγを介さない作用機序として、CRTH2(=chemoattractant receptor homologous molecule expressed on Th2=DP2)受容体を介する経路があり、15d-PGJ2は、好酸球・Th2リンパ球・好塩基球に選択的に発現しているこの受容体を介して、その濃度がnM~μMの濃度でCRTH2に作用した場合、好酸球の遊走活性のほか、CD11bの発現増強、アクチン重合を誘導するなど好酸球に対して活性化に働く。
そのほか、μMレベルの15d-PGJ2はPPARγ非依存的に好酸球のアポトーシスを誘導するが、これは、NF-κBに作用することで起こる。
つまり、15d-PGJ2はその濃度によって、PPARγ、CRTH2、NF-κBという3つの受容体に作用しうる。
合成PPARγアゴニスト(チアゾリジン系薬剤)は高濃度で好酸球の機能抑制に働く。
PPARs(Peroxisome proliferator-activated receptors)はPPARα、PPARδ(マウスではβ)、PPARγの3つのサブタイプがある。そのうちPPARα・γは単球・マクロファージ、リンパ球などの免疫担当細胞にも発現しており、インスリン抵抗性改善薬であるチアゾリジン系薬剤や、高脂血症薬であるフィブラート系の薬剤の作用機序として知られている脂質・糖代謝の調節作用とは別に、抗炎症分子として働いている。
PPARγは樹状細胞にも存在しており、肺の所属リンパ節への遊走や、サイトカイン産生、抗原提示能を抑制する。
さらに、IL-4によるIgEクラススイッチを阻害することや、アトピー性皮膚炎患者のIgE産生を抑制することも示されている。
好酸球はPPARαも発現しており、IL-5に対する遊走や、好酸球の持つ細胞傷害性も抑制するなど、PPARγと同様、PPARαは好酸球の機能抑制に関与している。
| PPARα | PPARδ | PPARγ | |
| 発現 | 肝臓、腎臓、腸管、心筋、骨格筋、副腎、免疫系細胞 | 全身に広く分布 | 免疫系細胞 大腸、脂肪細胞 |
| 機能 | 脂質代謝 ペルオキシソーム増殖 炎症制御 |
脂肪燃焼 | 脂肪細胞分化 炎症制御 インスリン感受性 |
| リガンド | LTB4 フィブラート系 8-HETE 長鎖脂肪酸 |
長鎖脂肪酸 プロスタサイクリン |
15d-PGJ2 チアゾリジン系薬剤 9-HODE、13-HODE、15-HETE NSAIDs 長鎖脂肪酸 |
PGE2及びPGI2はヒスタミン放出抑制、LTC4産生抑制作用などアレルギー性炎症応答を負に制御する。
COXを阻害するNSAIDsはPGによる炎症を抑える反面、PGE2、PGI2のアレルギー抑制作用を抑制したり、LT類の相対的な増加による気管支収縮という悪い面もある(例:アスピリン喘息)。
| 部位 | PGE1 | PGE2 | PGI2 | PGF2α | PGD2 | PGA2/B2/C2 | PGG2/H2 | PGJ2 | TXA2 |
| 血管平滑筋 | 弛緩 | 拡張 | 収縮 | 収縮 | 収縮 | 拡張 | 収縮 | ||
| 気管支平滑筋 | 弛緩 | 収縮 | 収縮 | 収縮 | 収縮 | ||||
| 子宮筋 | 収縮 | 収縮 | |||||||
| 血小板凝集 | 抑制 | 抑制 | 抑制 | 抑制 | 促進 | 促進 | |||
| 白血球遊走 | 好酸球 遊走 | ||||||||
| ブラジキニン増強 | 増強 | ||||||||
| 胃粘膜粘液分泌 | 促進 | 促進 | |||||||
| 胃酸分泌 | 抑制 | 抑制 | 抑制 | ||||||
| 睡眠誘発 | 促進 | ||||||||
| 抗腫瘍作用 | あり |
熱などのときの体温上昇はPGE2による。
また、PGE2は、15-リポキシゲナーゼの発現を誘導し、リポキシン産生を促進する。
PGE2とPGI2は知覚神経のブラジキニン感受性を増強させて疼痛を発現させる。
- CD
- 樹状細胞
- NK細胞
- リバウンド
- B細胞
- キラーT細胞
- 感作
- リンパ球
- アラキドン酸カスケード
- Igの構造
- サイトカイン
- ニューロペプチド
- セラミド
- 界面活性剤
- 好酸球
- ケモカイン
- インテグリン
- レギュレーターリスト
- 色素沈着
- 成長因子(GF)
- 活性酸素(ROS)
- NF-κB
- アレルギーの種類
- 骨代謝
- 抗菌ペプチド
- ヘルパーT細胞
- 好塩基球
- 薬の正しい使い方
- 血液凝固反応
- テオフィリン・β刺激薬の抗炎症作用
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


