ビグアナイド剤(メトホルミン)
| 分類 | 成分名 | 商品名 | 規格・剤形・補足 |
|---|---|---|---|
| ビグアナイド | メトホルミン | メトグルコ | 規格:錠250mg/500mg、MAX2250mg/日 適応:2型糖尿病(ただし、食事療法・運動療法又は加えてSU剤を使用のいずれかで十分な効果が得られない場合に限る。)、多嚢胞性卵巣症候群における排卵誘発、多嚢胞性卵巣症候群の生殖補助医療における調節卵巣刺激(ただし、肥満、耐糖能異常、又はインスリン抵抗性のいずれかを呈する患者に限る。) 補足:オルメサルタンと一包化×、1500mg/日↑長期投与でVB12欠乏のリスク有 |
| グリコラン | 規格:錠250mg、MAX750mg/日 適応:2型糖尿病(ただし、食事療法・運動療法又は加えてSU剤を使用のいずれかで十分な効果が得られない場合に限る。) |
||
| ブホルミン | シベトス | 規格:錠50mg 適応:2型糖尿病(ただし、SU剤が効果不十分な場合あるいは副作用等により使用不適当な場合に限る。) |
|
| シベトンS | 規格:腸溶錠50mg 適応:上に同じ |
||
| 配合剤 | メトアナ エクメット メタクト |
ビグアナイド剤(メトホルミン)の作用機序
メトホルミンは電子伝達系で呼吸鎖複合体Ⅰ(NADH-ユビキノン酸化還元酵素)を阻害&NADHをミトコンドリアに輸送する酵素を阻害して、ATP量を相対的に減らす。(NADHからの電子をユビキノンへ伝達する反応(NADH + ユビキノン → NAD+ + ユビキノール)を抑制する)
→結果、生成するATPが減って相対的にAMPが増え、肝臓においてATP/AMP量を検知(細胞内AMP/ATP比率が上昇すると活性化し、ATP合成側にシフトさせる)するタンパク質であるAMPKK(CamKK/LKB1/TAK1)が活性化され、AMPKKにAMPキナーゼ(セリン・スレオニンキナーゼ)がリン酸化されることで活性化され、
- 糖新生(グルコース以外からグルコースを作る経路)の抑制(HNF4、CRTC2、HDAC等)・・・1
- 糖の取り込みを増やす(GULT4のトランスロケーション)(TBC1D1)・・・3
- 細胞内での解糖系を促進(糖を分解する律速酵素:PFKFB3)
- 脂肪酸の合成を抑制し、脂肪の分解を促進(ACC、SREBP-1、HCL、ATGL)・・・2
- コレステロールの合成を抑制(HMG-CoAレダクターゼ)・・・2
- グリコーゲンの合成を抑制と分解促進(GS)・・・・7
- タンパク質の合成を抑制(TSC2、Raptor、TIF-IA、eEF2K)・・・6
- オートファジーの活性化(ULK1)
等の作用を示す。
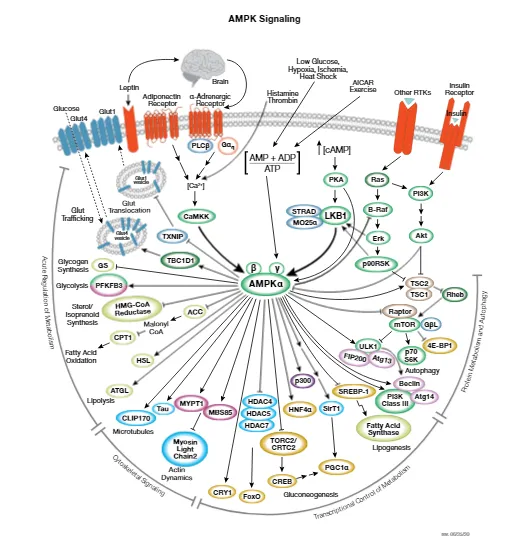
複合体Ⅰをほどほどに阻害するので治療薬となりえる。完全阻害はシアンと同じで毒(ATP完全阻害)になる。
複合体Ⅰの阻害作用により、NAD+が減少すると、それを使用するクエン酸回路が回らなくなり、NADH2を使用したピルビン酸から乳酸への反応が進み、乳酸が蓄積する。複合体Ⅰの阻害は結果的に酸素の取り込みも抑制されるので嫌気的条件に移行しやすい状態となり乳酸がさらに蓄積しやすくなる。
また、複合体Ⅰ阻害作用とは別に、ミトコンドリア内膜の膜間腔側に表在するグリセロールリン酸シャトルのFAD依存性グリセロール-3-リン酸デヒドロゲナーゼ(mGPDH=mGPD2)を抑制し、【グリセロール3-リン酸 + ユビキノン → グリセロンリン酸(=ジヒドロキシアセトンリン酸) + ユビキノール】の反応を抑制する。
複合体II(コハク酸-ユビキノンレダクターゼ)の反応も、ユビキノンを電子受容体として使用する点では同じだが、電子の供給源が異なる。複合体IIは、コハク酸の酸化(コハク酸→フマル酸+2H++2e-)と同時にFADをFADH2に還元し、その後、このFADH2からの電子をユビキノンに伝達してユビキノールを生成(FADH2+ユビキノン→FAD+ユビキノール)する。
したがって、両者の反応は電子の供給源となる物質(グリセロール3-リン酸とコハク酸)が異なる点で区別されるが、ユビキノンを電子受容体として使用する点では同じである。
すなわちmGPDHを抑制することは、電子伝達系を阻害することであり、複合体Ⅲを介した反応を抑制しATP量を減らすとともに、グリセロールリン酸シャトルで対で動いているNAD依存性グリセロール-3-リン酸デヒドロゲナーゼ(cGPDH)によるNAD+生成を減少させ、NAD+を利用する乳酸デヒドロゲナーゼが阻害=乳酸からピルビン酸への経路が阻害され、乳酸の蓄積が進むと思われる(管理人推測)。
イメグリミンは複合体Ⅲを活性化する作用もあるので、メトホルミンよりATP産生に影響しにくいのと、mGPDH阻害作用がないので乳酸蓄積がメトホルミンより少ないといわれる。
以上を踏まえたうえでメトホルミンの作用をまとめると、
-
肝臓における糖新生抑制作用
AMPK(AMP活性化プロテインキナーゼ)を介して、糖新生に関わる酵素の発現(肝臓でHNF4(hepatocyte nuclear factor4)やCRTC2(CREB regulated transcription coactivator2)等の転写因子を阻害)を抑制することで、肝ブドウ糖放出を抑制する。 NADH濃度の上昇と酸素取り込みの抑制により乳酸合成が促進されるため、乳酸の糖新生は抑制される。
AMPKの活性化により、糖新生に関与する酵素、PEPCK(ホスホエノールピルビン酸カルボキシキナーゼ)やG6Pase(グルコース-6-ホスファターゼ)が抑制されて糖新生が抑制される。
また、FOX01やSIRT1等をリン酸化して、他の(乳酸が関わらない)糖新生に関わる酵素のリン酸化=不活性化にも関与する。 -
肝臓における脂肪酸合成抑制と脂肪酸取り込み促進とβ酸化の抑制、コレステロール合成抑制
AMPKの活性化によりAMPKがアセチルCoAからマロニルCoAへの転換を触媒させ、脂肪合成に必須の酵素であるアセチルCoAカルボキシラーゼ(ACC)をリン酸化することにより、ACCの活性を低下させ脂肪酸合成を低下させる。
また、ACC不活性化によりマロニルCoAの生成が低下すると、脂肪酸酸化に関わるカルニチンパルミトイルトランスフェラーゼ1(CPT-1)の活性が増強して、ミトコンドリアへ脂肪酸酸化のための輸送が促進される(脂肪酸取り込み促進)。
AMPKはHMG-CoAレダクターゼをリン酸化して不活性化してスタチンと同じようにコレステロールの合成を抑制する。
インスリンは脂肪細胞へのグルコース取り込みを促進してTG合成を促進したり、LPL活性化で脂肪酸を増やして脂肪細胞が取り込めるようにしたり、HSLを抑制して脂肪細胞内のTGの分解を抑制したりすることで体重が増加する。インスリンが担う糖新生抑制作用でも糖新生を回すエネルギーが脂肪酸のβ酸化から調達されていることから、糖新生を抑制するとβ酸化が抑制され、体重増加が起こることがある。
インスリン分泌を促進するSU剤やグリニド剤は体重が増加する(チアゾリジンは浮腫による体重増加)と言われるが、ビグアナイドは体重増加は起こらないとのこと。 -
骨格筋におけるグルコースの取り込み促進作用
AMPKは骨格筋において、TBC1D1をリン酸化して、最終的に小胞体の糖輸送担体(GLUT4)の細胞膜上への移行を促進、あるいはGLUT4の発現を促進することなどにより、筋肉内のグルコースの取り込みを増加させる。なお、GLUT4の発現調節にはMEF2(myocyte enhancer facitor2)やGEF(GLUT4 enhancer factor)の2つの転写因子のリン酸かが関わる。 -
食欲抑制、体重減少作用
グレリンやGLP-1などの食欲調節作用のある消化管ホルモンに影響を及ぼすとの報告がある。 -
腸管への直接作用
小腸L細胞に直接作用してGLP-1を放出させる。(胆汁酸に対する作用。胆汁酸がGLP-1を分泌する)
門脈、静脈内投与に比べ、十二指腸内投与は血糖値をより低下。(メトホルミン血中吸収前に十二指腸に直接作用し、肝糖放出を抑制)
腸内細菌への作用:エンドトキシンLPSは、腸管から血中及び肝臓へ行こうし、インスリン抵抗性を惹起するが、メトホルミンはLPSを低下させ、血中、肝でインスリン抵抗性を改善する。 - 抗がん作用
AMPKは、TSC2、Raptor、TIF-IA、eEF2Kをリン酸化してタンパク合成を阻害する。TSC2が活性化されている時は、mTORC1に対して負に制御する=TSC2のAktによるリン酸化とは異なる部位をリン酸化してGAP活性を増大させ,mTORC1活性を低下させる=抗がん作用。 - グリコーゲン合成抑制、分解促進作用(骨格筋)
AMPKは、骨格筋ではグリコーゲンホスホリラーゼをリン酸化して活性化し、同時にグリコーゲンシンターゼをリン酸化してグリコーゲン合成を抑制することで、グルコースを増やして解糖系を回す。
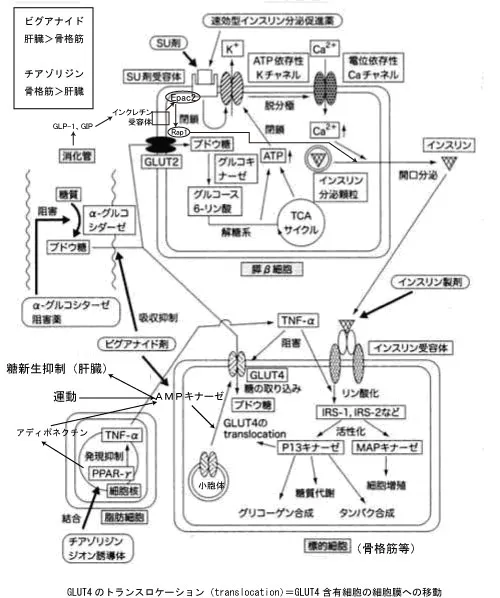
インスリンは、mTORC2からのAktの活性化→mTORC1を活性化してタンパク合成や細胞生存等の数々の作用を示す。mTORC2はインスリン刺激時にグルコーストランスポーターGLUT4の細胞膜へのトランスロケーションに関与する
インスリン刺激時の糖新生抑制作用は,mTORC2→Aktの活性化を介するFoxO1(糖新生の鍵酵素であるグルコース-6-ホスファターゼ(グルコース6リン酸からリン酸を除去する酵素)やホスホエノールピルビン酸カルボキシキナーゼ(オキサロ酢酸をホスホエノールピルビン酸と二酸化炭素に転換する酵素)の発現を誘導する)のリン酸化(不活性化)が関与している。
つまり、インスリンはGULT4の細胞膜へのトランスロケーションによる糖の取り込み促進作用と、糖新生の抑制作用がある。ということ。
ビグアナイドにより活性化されるAMPKは低血糖や低酸素状態、虚血、熱ショックなど、細胞へのATP供給を枯渇させるストレスに応答して活性化される。AMPKの活性化は、脂肪酸酸化やオートファジーなど、細胞のATP供給を補充するシグナル伝達経路を正に制御する。また、糖新生、脂質およびタンパク質合成など、ATPを消費する生合成プロセスは負に制御する。(参考:AMPKのリン酸化メカニズムと役割)
つまり、ビグアナイドはAMPKの働きにより、インスリンと同じようなGULT4の細胞膜へのトランスロケーションによる糖の取り込み促進作用(糖の取り込みは骨格筋限定であり脂肪細胞への取り込みは促進しない=体重増加が起こらない)と、糖新生の抑制作用がある。ということ。
ビグアナイド剤の種類
- メトグルコ(メトホルミン)・・・通常、成人には1日500mgより開始し、1日2~3回に分割して食直前又は食後に経口投与する。維持量は効果を観察しながら決めるが、通常1日750~1,500mgとする。なお、患者の状態により適宜増減するが、1日最高投与量は2,250mgまでとする。
オルメサルタンと一緒に一包化するとメトホルミンのグアニジノ基とオルメサルタンのDMDO基が反応して、メトホルミンがランソプラゾールOD15に見えます→一包化不可。 - ジベトンS(ブホルミン)
- 配合剤(メタクト、エクメット、イニシンク)・・・エクメットLDはメトホルミン250mg分2、メタクトとイニシンクはメトホルミン500mg分1、エクメットHDはメトホルミン500mg分2。250mg朝夕でも500mg朝でも24時間平均血糖、SD、HbA1c、尿中アルブミン、BWの有意な上昇はない(低下例すらある)。メトホルミンは血中半減期と作用感が完全に同じではない可能性が考えられ、血中メトホルミンを介さない消化管での直接作用の寄与も示唆される。
昔は全ての腎機能障害患者において使用できなかったが、2016年から軽度の腎機能障害患者に対しては慎重投与できるようになった(以前として中等度以上の腎機能障害患者には禁忌、75歳以上の高齢者には伸長に投与する)。
Recommendationによれば、eGFRが30未満が禁忌、30~45の場合は慎重投与(750mg/日以下が目安)、45~60(1500mg/日以下が目安)でも腎血流量を低下させる薬剤(ヨード造影剤、ARB、ACE、利尿薬、SGLT2阻害薬、NSAIDs等)の併用で腎機能が悪化する場合があるので注意することとでている。
腎排泄に関与するトランスポーター(MATE1)を阻害する薬剤としてシメチジンがある。シメチジン併用でメトホルミンのCmaxは60%上昇し、AUCは約40%増加したとされている。
肝機能障害はAST/ALT100以上の場合に投与を中止するかを検討する。
ヨード造影剤は一過性の腎機能低下を来す可能性があるため、メトホルミンと一緒に服用すると腎排泄が低下して乳酸アシドーシスのリスクが高まる。そのため、ヨード造影剤投与後48時間はメトホルミンの投与を再開しないこととされている。
X線やCTで使用される陽性造影剤にはヨードのほかにバリウムもあるが、これは特に影響しない。また、MRI造影剤のガドリウム製剤や超常磁性酸化鉄、肝細胞特異的MRI造影剤なども影響しない。
乳酸アシドーシス
ビグアナイド系薬剤は、主に肝ミトコンドリアの細胞膜に結合して好気的条件下における酸化的リン酸化を阻害し、乳酸からの糖新生を抑制することにより血糖を下げるため、乳酸産生が増加する。
通常はそれに応じて乳酸の代謝が増加し、乳酸値のバランスは保たれるが、肝での代謝能以上に乳酸が増加した場合や、肝での乳酸の代謝能が低下している場合にはこのバランスが崩れ、血液のpHが酸性側(7.10未満)に傾き、乳酸アシドーシスが発現する。
乳酸アシドーシスの初期症状は、悪心、嘔吐、腹痛、下痢などの胃腸症状、倦怠感、筋肉痛、アセトン臭を伴わない過呼吸が特徴的で、いったん発症すると急激に全身状態が悪化し、死に至ることもある重大な副作用なため、服用中に倦怠感、意識障害などの症状が出現していないか注意する。
悪心や下痢といった副作用は乳酸アシドーシスが原因で起きることもありますが、多くはメトホルミン自体の消化器官に与える影響によって引き起こされる。
メトホルミンは、主に腸から吸収され、OCT1(有機カチオントランスポーター1)を介して肝臓へ輸送されるが、この影響が下痢と考えられている。下痢はアシドーシスを促進するので悪循環になりかねないため、下痢の際は中止することが望ましい。
乳酸アシドーシスが疑われる場合は、直ちにビグアナイド系薬剤の投与を中止し、血液透析による乳酸とビグアナイド系薬剤の除去、輸液による強制利尿(乳酸を含む輸液は使用不可)、炭酸水素ナトリウム静注等によるアシドーシスの補正(過剰投与によるアルカローシスに注意)等の適切な処置を行う。
乳酸アシドーシスのリスク要因としては
- 腎機能障害患者(透析患者を含む)・・・eGFR 30ml/分/1.73㎡未満の患者で特に起こりやすくなる→なので以前は中等度の腎機能障害で禁忌だったが今は重度のみ禁忌
- 脱水、シックデイ・・・メトホルミンの濃度上昇により酸化的リン酸化が阻害→乳酸の蓄積(好気的条件下)等。夏の暑い時期や下痢嘔吐などで脱水が起こるとアシドーシスが起こりやすい
- 過度のアルコール摂取・・・過度のアルコール摂取→アルコール代謝にNAD+が消費されるので乳酸からピルビン酸への転換が阻害される(嫌気的条件下)
- 心血管・肺機能障害、手術前後、肝機能障害などの患者・・・嫌気的条件下の経路が促進する→乳酸産生の増加
- 高齢者
- ヨード造影剤
などがあげられている。
(参考文献・引用元:武田Webセミナー2017.11.6、AMPKWiki)
ビタミンB12欠乏
長期的な服用で、ビタミンB12の吸収不良が起こる例があるため、貧血や神経症状に注意する。
糖尿病の薬の種類
- インスリン製剤
- GLP-1受容体作動薬
- SU剤(スルホニルウレア剤)
- グリニド剤(速効型インスリン分泌促進薬)
- ビグアナイド剤
- グリミン系(ツイミーグ(イメグリミン))
- チアゾリジン剤
- α-グルコシダーゼ阻害薬
- DPP4阻害薬
- SGLT2阻害薬
- 糖尿病性神経症治療薬
- 糖尿病性腎症治療薬
- 配合剤
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


