チロシンキナーゼ型受容体
チロシンキナーゼ型受容体は増殖因子(成長因子:GF)の受容体です。ただ、成長因子の中でTGF-βだけは、セリン-スレオニンキナーゼ型受容体であるので、例外としてここには含めません。
ところで、前項で述べた「多くのタンパク質はリン酸化されることで活性化され、脱リン酸化されることで不活性化される(※1)」ということは覚えていただけているでしょうか??
※1 脱リン酸化で活性化される場合やリン酸化で不活性化されるケースも有る(カルシニューリンのNFATの脱リン酸化が活性化等)
チロシンキナーゼ(PTK:protein tyrosine kinase)はタンパク質のリン酸化されうるアミノ酸(セリン、スレオニン、チロシン)の中のチロシンをリン酸化する酵素であり、このチロシンキナーゼ活性を持つ受容体のことをチロシンキナーゼ受容体と呼びます。
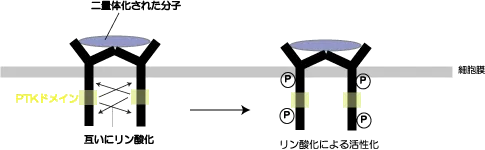
この受容体はチロシンをリン酸化することで、標的タンパク質を活性化することが目的なのですが、自分(チロシンキナーゼ型受容体自身)もリン酸化されないと活性化されないため、GFが受容体に結合しただけでは自身のリン酸化は起こらず、シグナル伝達はまったく進んでいきません。
自身活性化のために必要なこと、それは・・・「二量体化」です。 つまり、お互い自分をリン酸化したいとおもっているPTK型受容体が2つ寄り添って、互いに相手をリン酸化してあげることで活性化させるということです。
シグナル伝達というのは二量体化によって進行するパターンがほとんどで、アトピー性皮膚炎でよく知られるIgEの受容体(FcεRI)も抗原を介して隣の受容体同士で架橋して凝集することで肥満細胞、好塩基球などの脱顆粒が起こります(PDGFは二量体分子、EGFは二価の分子により多量体化する)。
受容体のリン酸化が起こると、リン酸化されたチロシンを認識する、SH2(src homology 2)ドメインを持つタンパク質が結合します。
SH2ドメインを持つタンパク質はたくさんあって、このリン酸化部位には、どのタンパク質であってもSH2ドメインを持っていさえすれば結合できるので、実にたくさんの ルートでシグナル伝達が進行することになります。
リン酸化されたチロシンとSH2は鍵と鍵穴の関係があることを覚えておきましょう。
以下にSH2ドメインを持つタンパク質のいくつかをまとめてみました。
| 分類 | タンパク質名 | シグナル |
| アダプター分子 | Grb2 | |
| SHP-2 | ||
| PI3K | ||
| ドッキングタンパク質 | IRS | インスリン |
| Dok | インスリン | |
| P130cas | 細胞骨格 | |
| Shc | 細胞増殖 | |
| SLP-76 | T細胞活性化 | |
| LAT | T細胞活性化 |
SH2ドメインをもつタンパク質は、それ自身が転写因子として作用することはなく、別のタンパク質を活性化するアダプタータンパク質として作用します。
アダプター分子は1つのリン酸化部位に対して1つのタンパク質を仲介する作用を示しますが、ドッキングタンパク質は、ハブのように、1つのリン酸化部位に対して複数の タンパク質を仲介することが出来ます。

Grb2はSH2ドメインのほかに、SH3ドメインというものも持っています。このSH3ドメインは、タンパク質のプロリンリッチな部分に結合することが出来るドメインで、上図ではSOSというタンパク質のプロリンの繰り返し配列部位に結合しています。
SOSはGEFとしての作用を持つタンパク質であり、不活性化されているGDP-Rasを活性型のGTP-Rasに変換して、最終的にMAPKカスケードを進行させます。
また、LATをはじめとしたドッキングタンパク質は、たくさんのチロシン残基を持つため、自身がリン酸化されると、SH2ドメインを持つタンパク質をたくさん結合することが出来ます。
このようにバトンリレーのごとく一連の反応が起こると共に、その一つ一つのシグナルがお互いにクロストークしあって、転写因子が活性化し、目的のタンパク質(アトピーならIL-4,5などのサイトカインとか)が合成されます。
まとめると、増殖因子のシグナル伝達(PI3K/Akt経路)は、がん等増殖因子によるシグナル伝達。
mTOR阻害薬は抗がん剤。機序的にメトホルミンも抗がん剤になりうる。
TCRからのシグナル伝達では非受容体型PTKが、PIP2をIP3とDAGに分解するところからのシグナル伝達に対して、増殖因子のシグナル伝達では受容体型PTKからの、PI3KがPIP2をリン酸化してからのシグナル伝達
- 1. 増殖因子受容体(PTK)はPI3Kを活性化し、PI3KはPIP2をリン酸化してPIP3にする(逆にPTENは脱リン酸化してPIP2に戻す=Aktを阻害し腫瘍を抑制する)。
- 2. PIP3はPHドメインを持つPDK1と結合し、PDK1はAkt(プロテインキナーゼB)をリン酸化して活性化
- 3. AktはmTORC1(mTOR複合体1)を介して様々な生理反応(細胞成長、生存、翻訳によるタンパク合成、オートファジーによるATP獲得など)を引き起こす。
- mTor:哺乳類ラパマイシン標的タンパク
- PI3K:ホスファチジルイノシトール3キナーゼ(キナーゼ=リン酸化酵素)。細胞膜のイノシトールリン脂質のリン酸化を行うリン酸化酵素
- SHドメイン:リン酸化したチロシンを認識する
- PH(プレクストリン相同)ドメイン:タンパク質ドメインの1つ。PHドメインを持つ酵素群はホスホイノシトール(PIP2やPIP3など)のリン酸基と結合する。AktはPHドメインを持ち、PHドメインはPIP2やPIP3に結合する。PDK1(ホスホイノシチド依存性キナーゼ)もPHドメイン
- PLC(ホスホリパーゼC):PIP2をIP3とDAGに分解する
- Akt:プロテインキナーゼB=リン酸化酵素のこと。セリン/スレオニンキナーゼ。PHドメインを持つ。PIK3ファミリー酵素のみによりリン酸化される。
- 4. インスリンはmTORC2からのAkt活性化→TSC2がリン酸化されると複合体の活性が抑制されて、Rheb(抑制性制御因子のTSC1-TSC2複合体によって制御されている低分子量GTP結合タンパク質)の活性が上昇し、mTORC1を活性化する
- 5. PDK1とmTORC2によるAktのリン酸化部位は異なり、両者によるリン酸化が最大の活性化に必要。
- mTor1がラパマイシン感受性。mTOR、Raptor、およびmLST8から構成。翻訳抑制因子4E-BP1およびリボソームタンパク質S6キナーゼ(S6K)の両方をリン酸化することによって、細胞の成長および増殖を制御
- mTor2はラパマイシン抵抗性。mTOR、Rictor、mLST8、およびmSin1から構成。AktやSGK1、PKCαをリン酸化、細胞増殖、生存の制御。mTORC2はインスリン刺激時にグルコーストランスポーターGLUT4の細胞膜へのトランスロケーションに関与する.一方,インスリン刺激時には糖新生が抑制されるが,これにもmTORC2はAktの活性化を介するFoxO1のリン酸化(不活性化)を通して関与している.。FoxO1は肝臓における糖新生の鍵酵素であるグルコース-6-ホスファターゼやホスホエノールピルビン酸カルボキシキナーゼの発現を誘導するが,インスリン刺激によるmTORC2?Akt経路によりリン酸化されたFoxO1は核内輸送が阻害されるため,これらの遺伝子の発現は抑制される
- 6. また、AktはIKK複合体(IKKα/IKKβ/MEMO)を活性化→IκBがリン酸化(ユビキチン化)からプロテアソームで分解されると、NF-κBとIκBの結合が切り離され、NF-κBがフリーになり核内へ移行→サイトカイン(IL-1、TNF-α等)の合成が進む。NF-κBの活性化ルートは他にToll-like受容体やTNF-α受容体からのルートもある。
- 7. ビグアナイドによる活性化されるAMPKは低血糖や低酸素状態、虚血、熱ショックなど、細胞へのATP供給を枯渇させるストレスに応答して活性化されます。AMPKの活性化は、脂肪酸酸化やオートファジーなど、細胞のATP供給を補充するシグナル伝達経路を正に制御する。
- 8. また、糖新生、脂質およびタンパク質合成など、ATPを消費する生合成プロセスは負に制御します。→mTORC1に対しては負に作用する=TSC2のAktによるリン酸化とは異なる部位をリン酸化してGAP活性を増大させ,mTORC1活性を低下させる=抗がん作用
- DNAと遺伝子とは
- DNAの転写
- タンパク質の合成
- 初期mRNAを作るまで
- チロシンキナーゼ型受容体
- JAK-STAT型受容体
- TGF受容体
- TNF受容体
- Wnt受容体
- Notch受容体
- Toll-like受容体
- NOD-like受容体
- RIG-like受容体
- MAPKカスケード
- タンパク質の分解
- 癌抑制遺伝子p53
- CKIとは?
- 細胞周期
- DNAの複製
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


