ユビキチンとタンパク質分解
シグナル伝達にかかわるタンパク質は、リン酸化・脱リン酸化にて活性・不活性が調節されるだけでなく、不可逆的に分解される場合があります。
この不可逆な分解を受ける基質には、βカテニン、lκBα、p53らが該当しています(他はよくわからず・・・)。
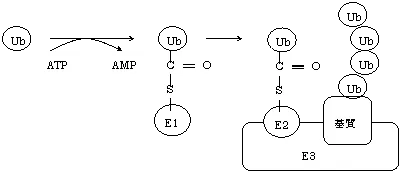
これらは、リン酸化を受けたものが活性体ではなく、逆に、ユビキチンリガーゼという酵素によって、 エネルギー依存(ATP分解)に、ユビキチン(標的タンパク質のリジン残基に結合するアミノ酸) が付加されて、最終的にプロテアソームにて分解されます。
詳しく言うと、ユビキチンを付加するのには、ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチンリガーゼ(E3)の3つの酵素が必要です。 E1はユビキチンのC末端をアデニル化してチオエステル結合を形成する。
この活性化されたユビキチンがE2にチオエステル結合した後、標的基質分子を認識する E3を介して基質分子のリジン残基にイソペプチド結合で付加される。
さらに付加されて、鎖状になったポリユビキチンは26Sプロテアソームにより認識されて分解を受けます。
- DNAと遺伝子とは
- DNAの転写
- タンパク質の合成
- 初期mRNAを作るまで
- チロシンキナーゼ型受容体
- JAK-STAT型受容体
- TGF受容体
- TNF受容体
- Wnt受容体
- Notch受容体
- Toll-like受容体
- NOD-like受容体
- RIG-like受容体
- MAPKカスケード
- タンパク質の分解
- 癌抑制遺伝子p53
- CKIとは?
- 細胞周期
- DNAの複製
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


