目次
糖代謝の前提知識
糖代謝全体マップは以下図参照。
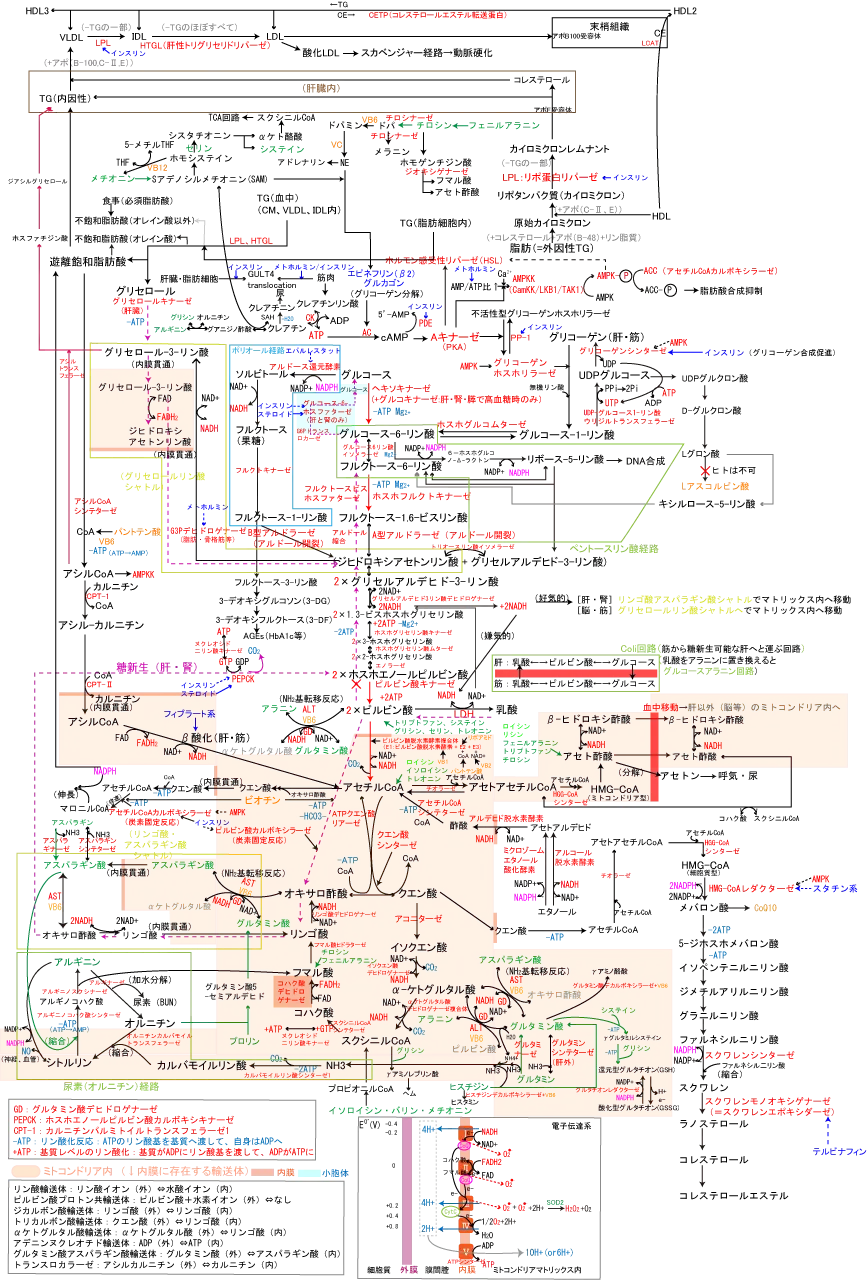
- グルコース1モルからのATPとNADH、FADHの収支。括弧内は赤血球で迂回路に入りホスホグリセリン酸キナーゼの反応がスキップされた場合。
1molのNADHは10H+の勾配を作り、4H+の勾配が1ATPであるので2.5molのATPを生成する。1molのFADH2は6H+の勾配を作るので1.5molのATPを生成する。使用 生成 収支 解糖系 2ATP 4(0)ATP
2NADH2(0)ATP
2NADH(=5ATP)PDH なし 2NADH 2NADH(=5ATP) TCA回路 なし 2GTP(=ATP)
6NADH
2FADH22ATP
6NADH(=15ATP)
2FADH2(=3ATP)合計 - - 32(30)ATP - ATP(アデノシン三リン酸)、ADP(アデノシン二リン酸)、NAD+(ニコチンアミドアデニンジヌクレオチド)、NADH(還元型ニコチンアミドアデニンジヌクレオチド)、FAD(フラビンアデニンジヌクレオチド)、FADH2(還元型フラビンアデニンジヌクレオチド)
- 1molのグルコースは分子量180なので約180g/mol、1molのグルコースにはアボガドロ数の分子が含まれる、1gのグルコースは(1/180)mol。グルコース1分子は(1/アボガドロ数)molであり、(180/アボガドロ数)グラム。
- グルコース1分子から得られるATP:約30~32分子のATP
- グルコース1molから得られるATP:約30~32molのATP。1molのグルコースは、アボガドロ数(約6.022×10^ 23)のグルコース分子を含んでいて30~32molのATPは、(30~32)×6.022×10^23分子のATP。
- グルコース1gから得られるATP:30~32/180molのATP。ATPのモル質量が507.18g/molなので、約84~90 gのATPが生成
- 1カロリー (cal) は、4.184ジュール (J) に等しい。グルコース1g=4kカロリーは16736ジュールに等しい。
- ATPの1molが加水分解されてADPになる際に放出されるエネルギーは、約30kJ/mol(=30/4.184=7.3kcal/mol)。32molのATPで約960kJ(229.4kcal)。1molのグルコースの完全酸化によって放出されるエネルギーは約686kcal/molで、このうちATPとして取り出せるのは229.4kcalで残りの約450kcalはATPの合成以外で使われたエネルギー(熱、他の代謝経路、エネルギー損失等)。
つまり、1gのグルコースを完全酸化させて水と二酸化炭素になった場合のエネルギーは約4kcalだが、1gのグルコースから作られるATPは約1.5kcalである。それもこれはATP→ADPで計算したものでATP→AMPであればさらにエネルギー量が多くなる。残りは他で使われるか蓄えられるかされたエネルギーである。 - 還元剤とは電子を与えて自分が酸化されるもの、酸化剤とは電子を受け取って自分は還元されるもの。
- NAD+は2つの電子(及び1プロトン)を受け取って自分が還元されるので酸化剤として働き、NADHは2つの電子(及び1プロトン)を与えて酸化されてNAD+とH+になる(NADH→NAD++2e-+H+)ので還元剤である。なお、NADH2+の表記はNADHの分子が2つの正の電荷をもつカチオンであることを示す形であり、NADH+H+と同じ意味(ここのH+はNADHが酸化されてNAD+に戻るときに放出されるプロトンを示す。ただわかりにくいので現在はNADHとの記載が主流)。
- ATPを使わない酵素をシンターゼ synthase、使う酵素をシンテターゼ synthetase と呼ぶ
- ATPが基質をリン酸化してADPになることは単にリン酸化反応の一つ、逆にADPが基質によりリン酸化されてATPになることを基質レベルのリン酸化と呼んでいる。
- ミトコンドリア内膜通過:ATP、ADP、ピルビン酸、クエン酸、αケトグルタル酸、リンゴ酸、グルタミン酸、アスパラギン酸
- ミトコンドリア内膜通過できない:NADH、アセチルCoA、アシルCoA、オキサロ酢酸
- 血液中を移動可能な物質:乳酸、ケトン体、グルコース、アミノ酸、脂肪酸、ビタミンとミネラル、コレステロールとリポたんぱく質、尿素、ホルモン、電解質等
- ケトン体・・・アセト酢酸、βヒドロキシ酢酸、アセトンの総称
- 活性酸素(Reactive Oxygen Species, ROS)・・・スーパーオキシドアニオン、過酸化水素、ヒドロキシラジカル、一酸化窒素、ペルオキシニトリート、シングレット酸素等
- 活性酸素の作用・・・強力な酸化剤。他の分子(脂質、タンパク質等)から電子を引き抜く(酸化する)ことができる。活性酸素は電子が1つ過剰なので電子を与えるかと思いきや生物学的な環境下では引き抜く作用の方が強いため酸化剤としてふるまう。これに対して、ビタミンEやC、グルタチオン等の抗酸化物質はラジカルスカベンジャーとしてフリーラジカルを中和する作用がある。
- シャトル経路・・・内膜を通過できないNADHをミトコンドリア内にあたかも運んでいるように見せる経路。
- リパーゼ・・・脂肪を分解して脂肪酸とグリセロールに分解する酵素で大きく3つある。
- 膵リパーゼ:膵臓から分泌されて、小腸内で食物中のトリグリセリドを加水分解する。
- リポタンパク質リパーゼ:血液中に存在するキロミクロンやVLDLなどリポタンパク質のトリグリセリドを加水分解する
- ホルモン感受性リパーゼ:白色脂肪細胞内に蓄積されているトリグリセリドを加水分解する。
- 赤血球はミトコンドリアを持たない。脂肪細胞のうち脂肪をため込むだけの白色脂肪細胞もミトコンドリアがほとんどない。
- αケト酸とはカルボキシル基とケトン基を持つ有機化合物のことで、代表的なものがピルビン酸、αケトグルタル酸、オキサロ酢酸の3つ。
- HMG-CoAにはミトコンドリア型と細胞質型の2つがある。ミトコンドリア型はケトン体の合成に、細胞質型はコレステロールの合成に必要である。
- ΔGは自由エネルギーの変化
解糖系の流れ

解糖系とは全ての細胞の細胞質に存在する、「グルコースをピルビン酸に変換するまでの10段階の反応」のことで、その過程において前半で2ATPを消費して、後半で4ATP取戻し、正味2ATPと、2NADHを獲得できる。
途中のフルクトース1-6-ビスリン酸はアルドール開裂で2つに分けられて、結果、グリセルアルデヒド3-リン酸が2つできるので、1molのグルコースから2molのピルビン酸ができることに注意する。
- 1、グルコースがATPによってリン酸化される反応(不可逆、ΔGp:-33)で、グルコース6-リン酸とADPが生成する。この反応を触媒する酵素がヘキソキナーゼとそのアイソザイムであるグルコキナーゼ。グルコキナーゼは肝・腎・膵にのみ存在し、高血糖時にのみ作用する。
- 2、グルコース6-リン酸をアルドースからケトースへ異性化させフルクトース6-リン酸を生じる反応(可逆、ΔGp:-2)。この反応を触媒する酵素はグルコース6-リン酸イソメラーゼ。
- 3、フルクトース6-リン酸がATPによってリン酸化される反応(不可逆、ΔGp:-22)で、フルクトース1.6-ビスリン酸とADPが生成する。この反応を触媒する酵素がホスホフルクトキナーゼで、解糖系の律速酵素である。
- 4、フルクトース1.6-ビスリン酸がアルドール開裂によりジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸を生じる反応(可逆、ΔGp:-1)。酵素はA型アルドラーゼ。
- 5、ジヒドロキシアセトンリン酸とグリセルアルデヒド3-リン酸はトリオースリン酸イソメラーゼによって相互に変換(アルドースとケトースの変換、可逆、ΔGp:-3)できるため、解糖系においては2つのグリセルアルデヒド3-リン酸が生成するといえる。
- 6、グリセルアルデヒド3-リン酸がNAD+と反応する酸化還元反応(可逆、ΔGp:-2)で、グリセルアルデヒド3-リン酸は酸化されて1.3-ビスホスホグリセリン酸へとなり、NAD+は還元されてNADHになる。酵素はグリセルアルデヒド3-リン酸デヒドロゲナーゼ(GAPDH)。
- 7、1.3-ビスホスホグリセリン酸がADPをリン酸化(基質レベルのリン酸化)する反応で、3-ホスホグリセリン酸とATPが生成する(可逆、ΔGp:+1)。酵素はホスホグリセリン酸キナーゼ。アルドール開裂により2倍の2ATPが生成する。
- 8、3-ホスホグリセリン酸のリン酸基を3位から2位に移動させるだけの反応(可逆、ΔGp:+1)で、2-ホスホグリセリン酸が生成する。酵素はホスホグリセリン酸ムターゼ。
- 9、2-ホスホグリセリン酸から水(H2O)を除くだけの反応(可逆、ΔGp:-2)で、ホスホエノールピルビン酸が生成する。酵素はエノラーゼ。
- 10、ホスホエノールピルビン酸がADPをリン酸化(基質レベルのリン酸化)して、ピルビン酸とATPが生成する反応(不可逆、ΔGp:-17)。酵素はピルビン酸キナーゼ。
- ※生体内であっても細胞内基質濃度1Mにはるか満たないため、ΔG0'ではなくΔGpを用いる。
ピルビン酸デヒドロゲナーゼ複合体(PDH)の好気的条件下での反応
酸素が十分にある好気的な条件で進行する反応。
ピルビン酸がミトコンドリア内膜を通過して、マトリックス内へ移動することで行われる酸化的脱炭酸反応。
ピルビン酸をアセチルCoAに変換する不可逆な反応で、これを触媒するのが3つの酵素(E1,E2,E3)から成るピルビン酸デヒドロゲナーゼ複合体。
- E1:ピルビン酸デヒドロゲナーゼ
- E2:ジヒドロリポアミドアセチルトランスフェラーゼ
- E3:ジヒドロリポアミドデヒドロゲナーゼ
この反応は3つの酵素が関わる四段階の反応で進行する。
- 1、酵素E1に結合しているチアミンピロリン酸(ビタミンB1のリン酸化体)がピルビン酸の脱炭酸を行うことでCO2が取り除かれる。CO2が取り除かれたピルビン酸が酵素E2に結合しているリポアミド(リポ酸由来)にアセチル基に転移し、S-アセチルリポアミドを生成する
- 2、酵素E2に結合しているS-アセチルリポアミドがCoA(パントテン酸由来)にアセチル基を転移し、アセチルCoAとジヒドロリポアミドを生成する
- 3、酵素E3に結合しているがFAD(ビタミンB2由来)がジヒドロリポアミドを酸化して、リポアミドとFADH2を生成する
- 4、FADH2をNAD+(ニコチン酸由来)で酸化して、FADとNADHを生成する。
全体の反応式は、【2ピルビン酸+2CoA+2NAD+ → 2アセチルCoA+2CO2+2NADH】であり、1molのグルコースから2molのNADHとアセチルCoA、C02が生成する。
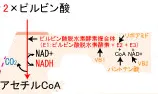
PDHの嫌気的条件下での反応(乳酸生成)
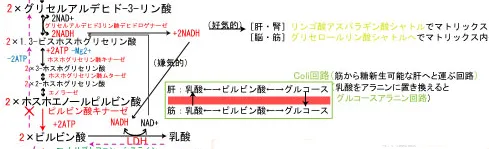
ピルビン酸は酸素が足りない状態ではLDH(乳酸デヒドロゲナーゼ)の作用で乳酸を合成する(ピルビン酸+NADH → 乳酸+NAD+)。
乳酸を合成する際にNADHが還元剤として使用されて、NAD+が生成し、そのNAD+がGAPDHの反応(グリセルアルデヒド3リン酸から1.3ビスホスホグリセリン酸への反応:ホスホエノールピルビン酸への中間体)で使われ、ピルビン酸を再度生成する過程で4ATP生み出す。
このサイクルは乳酸が蓄積していくので数分しか持続しない。
骨格筋に蓄積した乳酸は、血液を通じて肝臓に運ばれ、NAD+を使ってピルビン酸に変換される。その後、オキサロ酢酸を経由してグルコースを新たに生成するプロセス、糖新生(後述)が行われ、この新しいグルコースは再び血液を通して骨格筋に運ばれる。これを「コリ回路」と言う。
では、なぜこんなに手間がかかる方法を採用しているのかというと、2つの理由がある。
- ピルビン酸は、解糖系の逆経路でホスホエノールピルビン酸に直接変えることができない。そのため、オキサロ酢酸を介してホスホエノールピルビン酸に変換する必要がある。
- グルコースを再生する際の最後のステップを担う酵素、グルコース6ホスファターゼは肝臓と腎臓のみに存在する。このため、骨格筋に蓄積した乳酸は、先に肝臓へと運ばれ、ここでグルコースが生成され、その後骨格筋へと戻される。
その際発生したNADHは好気的条件下における電子伝達系で酸素を使用して処理しなければならない。
クエン酸(TCA)回路の流れ(好気的条件下)
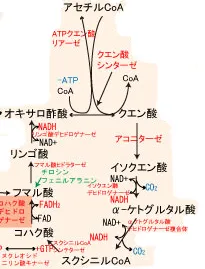
クエン酸はトリカルボン酸なので、TCA回路とも呼ばれる。
解糖系が細胞質ゾルで行われるのに対して、TCA回路はミトコンドリアのマトリックス内で行われる。
ここで重要なのはミトコンドリアの内膜輸送体(全体図参照)を介して内膜を通過してマトリックス内に入れる物質と入れない物質がどれか、入れない物質を通過したように見せかけるシャトル経路の存在である。
TCA回路はオクアサコフリンで進行する8段階の反応である。
- 1、アセチルCoAがクエン酸シンターゼ(合成酵素)の作用にて、アセチル基をオキサロ酢酸(αケト酸)に転移してクエン酸となる(不可逆、ΔG0':-31.4)
- 2、クエン酸はアコニターゼの作用で水酸基が移されてイソクエン酸となる(可逆、ΔG0':+6.3)。コレステロール合成のもととなるアセチルCoAはミトコンドリアからクエン酸を介して細胞質へ運ばれたものである。
- 3、イソクエン酸は酸化的脱炭酸反応でC02が除かれてαケトグルタル酸となる(不可逆、ΔG0':-8.4)。この際NAD+が補酵素として働き、NADHが生成する。
- 4、αケトグルタル酸がさらに酸化的脱炭酸反応でCO2が除かれた後CoAに転移し、スクシニルCoAとなる(不可逆、ΔG0':-30.1)。ピルビン酸デヒドロゲナーゼ複合体と同じ3つの酵素から成る複合体メカニズムも同じなため、NADHが生成する。
また、αケトグルタル酸はアミノ基転移反応の基質として重要であり、アミノ酸のアミノ基をグルタミン酸に集めて(肝外組織のアンモニアはグルタミンが運ぶ)尿素回路で捨てる目的と、ミトコンドリア内膜を通過できないオキサロ酢酸を細胞質へ移動させる目的、飢餓時にアラニンからピルビン酸経由でグルコースを作る目的がある。 - 5、スクシニルCoAはGDPをリン酸化(基質レベルのリン酸化)してコハク酸とGTPが生成する(不可逆、ΔG0':-3.3)。触媒酵素はスクニシルCoAシンテターゼである。GTPはヌクレオシド二リン酸キナーゼの反応でATPに変換される(ΔG0=0)ので収支計算ではATPとして取り扱う。
この反応は骨格筋等でケトン体をアセチルCoAに戻してTCA回路に入れる(ケトン体をエネルギーとして使う)際にも使用する。 - 6、コハク酸はコハク酸デヒドロゲナーゼとFADによりフマル酸に酸化されFADH2が生成する(可逆、ΔG0':0)。単なる酸化還元反応であるが、コハク酸デヒドロゲナーゼは唯一ミトコンドリア内膜に存在する酵素(コハク酸とフマル酸はマトリックス内に存在)で、電子伝達系における複合体Ⅱの成分でもある。
- 7、フマル酸はフマル酸ヒドラターゼにより二重結合が水和されてリンゴ酸になる(可逆、ΔG0':-3.8)。
- 8、リンゴ酸がNAD+に酸化されてオキサロ酢酸とNADHが生成する(可逆、ΔG0':+29.7)。触媒酵素はリンゴ酸デヒドロゲナーゼ。自由エネルギー差が大きなプラスだが、クエン酸シンターゼのマイナスに引っ張られる。
電子伝達系(好気的条件下)
電子伝達系とは、ミトコンドリア内膜において、解糖系とTCA回路で生成したNADHとFADH2の電子2個を最終的に酸素に移動し、酸素がこれらの電子を受け取ることによるNADHやFADH2の酸化と、それにより取り出した自由エネルギーを使ってADPをATPにリン酸化する機構である。
NADHやFADH2の酸化とADPのリン酸化から名前をとって、酸化的リン酸化と呼ばれている。
ミトコンドリアの作用
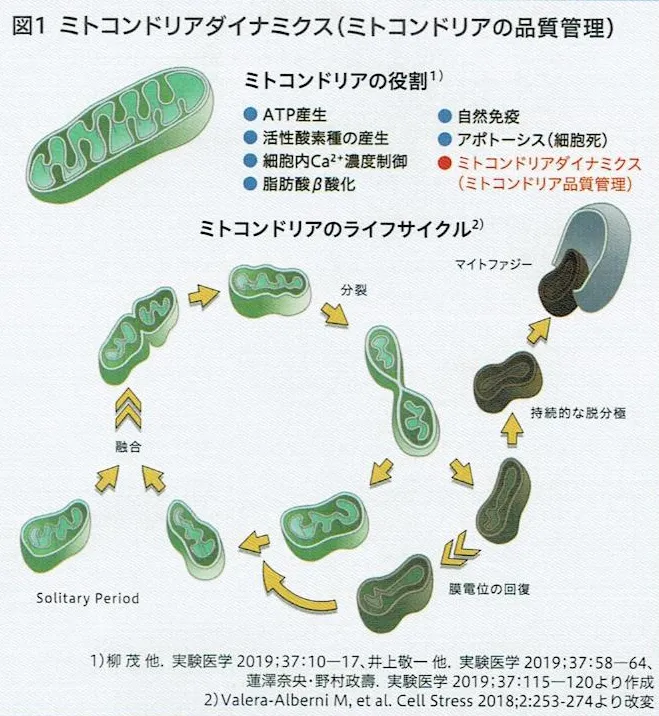
ミトコンドリアの主な作用は、酸化的リン酸化によるATPの産生とそれに伴う活性酸素(ROS)の産生ですが、他にも細胞内Ca2+濃度制御、自然免疫、アポトーシス誘導、ミトコンドリアの品質管理(再生不可能なものをマイトファジー(ミトコンドリアのオートファジーのこと)によって排除する。)等の作用がある。
ミトコンドリアの新生だけでなく分裂により生じた劣化したミトコンドリアをマイトファジーで排除できないと、肝臓のミトコンドリアであれば肝機能障害が引き起こされることがわかっている。
シャトル経路
細胞質で生成したNADHやFADH2はそのままではミトコンドリア内膜を通過できないことから、以下の2つのシャトル経路を使ってミトコンドリアのマトリックス内にNADHやFADH2が移動したように見せかける。
- リンゴ酸アスパラギン酸シャトル・・・肝臓・腎臓の細胞質で生成されたNADHはオキサロ酢酸を還元して、リンゴ酸とNAD+を生成し、生成したリンゴ酸が内膜を通過してマトリックス内のNAD+によって酸化されてオキサロ酢酸に戻る。この過程でNAD+がNADHに還元される。
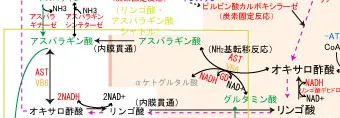
- グリセロールリン酸シャトル・・・脳や筋肉細胞の細胞質で生成されたNADHはNAD依存性グリセロール3-リン酸デヒドロゲナーゼ(cGPDH)によってジヒドロキシアセトンリン酸を還元し、グリセロール3-リン酸を生成する。この過程でNADHはNAD+に酸化される。
グリセロール3-リン酸はミトコンドリア内膜にあるFAD依存性グリセロール3-リン酸デヒドロゲナーゼ(mGPDH=mGPD2)によってFADを使用して酸化され、ジヒドロキシアセトンリン酸に戻る(グリセロール3-リン酸 + ユビキノン → グリセロンリン酸(=ジヒドロキシアセトンリン酸) + ユビキノール)。ユビキノンは電子を受け取ってユビキノールに還元される。この過程ではFADは電子受容体として使用されてFADH2に還元される。メトホルミンはmGPD2を抑制してATP量を減らす。
このシャトルはNADHからの還元力がFADH2を経由して電子伝達鎖に移されるため、細胞質のNADH1分子あたりのATP算出が低下するため効率的ではないが、筋肉細胞など一部の細胞では重要な役割を果たす。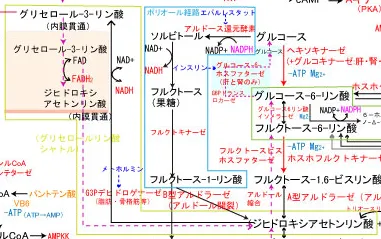
これによりミトコンドリア内のTCA回路で生成したNADHやFADH2だけでなく、細胞質で生成したNADHも電子伝達系へ入ることが可能になる。
電子伝達系の流れ

- 複合体ⅠはNADH-ユビキノンレダクターゼと呼ばれ、FMNとFe-S(鉄硫黄クラスター)タンパク質を含み、NADHからの電子をユビキノン(CoQ10)へ伝達する反応(NADH + ユビキノン → NAD+ + ユビキノールの反応を進める)と、その際に生じるエネルギーを使ってプロトンを4つ汲み出す反応を進める。(補酵素だがこの場合は複合体Ⅰとユビキノンが基質となる)
- 複合体Ⅱはコハク酸‐ユビキノンレダクターゼと呼ばれ、FADとFe-Sタンパク質を含み、FADH2からの電子をユビキノン(CoQ10)に伝達する反応(FADH2+ユビキノン → FAD+ユビキノール)を進める。複合体Ⅱではプロトンの汲み出しは起こらない。FADH2はコハク酸→フマル酸にする時と、先に述べたグリセロール3-リン酸をジヒドロキシアセトンリン酸にする時に生成し、共にユビキノンに電子を渡して電子伝達系を進行させる。
- 複合体ⅠとⅡで電子を受け取ったユビキノール(CoQH2)は、受け取った電子を複合体Ⅲ(ユビキノール‐シトクロムcレダクターゼ)を経てシトクロムcに渡す反応(ユビキノール + シトクロムc(Fe3+) → ユビキノン + シトクロムc(Fe2+)と、その際に生じるエネルギーを使ってプロトンを4つ汲み出す反応を進める。
ここでのFeはポルフィリン環に配位するヘム鉄のことであり、シトクロムcは電子を運搬するヘムたんぱく質である。 - 次に複合体Ⅳはシトクロムcオキシダーゼと呼ばれ、シトクロムc(Fe2+)からの電子を呼吸から得た酸素に渡し、水にする反応(シトクロムc(Fe2+)+1/2O2 → シトクロムc(Fe3+) +H2O)と、その際に生じるエネルギーを使ってプロトンを2つ汲み出す反応を進める。
- 全反応は、NADH + H+ + 1/2O2 → H2O + NAD+であり、自由エネルギーは状態量なので、これらの物質の標準酸化還元電位からネルンストの式を用いて自由エネルギーの差を計算すると各工程含めた全体でのΔGを求めることができ、ΔG0'=約-218(kJ/mol)となる。
このエネルギーが複合体Ⅰ、Ⅲ、Ⅳのプロトンポンプを動かして、プロトン(H+)を膜間腔へ移動させて、内外のプロトン濃度差(またはpH勾配)を生じさせる。 - ATPの産生は、この一連の電子伝達経路におけるH+の濃度勾配を利用して行われるが、この過程はATP合成酵素(または複合体V、ATPシンターゼとも呼ばれる)によって触媒される。
ADP + Pi + nH+(内側) → ATP + H2O + nH+(外側)
ここで、Piは無機リン酸を示し、nはミトコンドリアの内側から外側に移動するプロトンの数を示す。nは4(3個のプロトンがATP合成、1個のプロトンがリン酸基の輸送)とされ、4H+が1ATPに相当する。よって、1つのNADHは10個のH+を、FADH2は6個のH+を移動させるので、1molのNADHは2.5molのATPを、1molのFADH2は1.5molのATPを生成する。 - この過程において、本来は複合体Ⅳで電子はシトクロムcを介して渡されるはずが、複合体Ⅰ~Ⅲでの電子生成の際に漏れ出した一部の電子がそこで酸素と反応してしまい、酸素分子が一分子還元されてスーパーオキシド(活性酸素:ROSの一つ)がしばしば生成される。
このスーパーオキシドはSOD1やSOD2(スーパーオキシドジスムターゼ)によって抗酸化作用を受けて、過酸化水素へと変換されて、カタラーゼやGSHの作用で無害な水や酸素へと変換されるが、高血糖によりROS産生が過剰になるとミトコンドリアの機能異常が引き起こされる。ROSは抗酸化作用を受けないと、他の組織を攻撃したり、脂質を酸化させて過酸化脂質を作ったり悪影響を及ぼす。 - ※メトホルミンは複合体Ⅰを不競合阻害(基質濃度とは関係なく常に阻害し、酸素消費を低下させやすく、乳酸を生じやすい)し、イメグリミンは複合体Ⅰを競合阻害(基質濃度が低いとき阻害作用↑、高いと阻害作用↓→基質濃度が上がれば阻害しない)する。
肥満・高血糖・脂質がミトコンドリアに与える影響
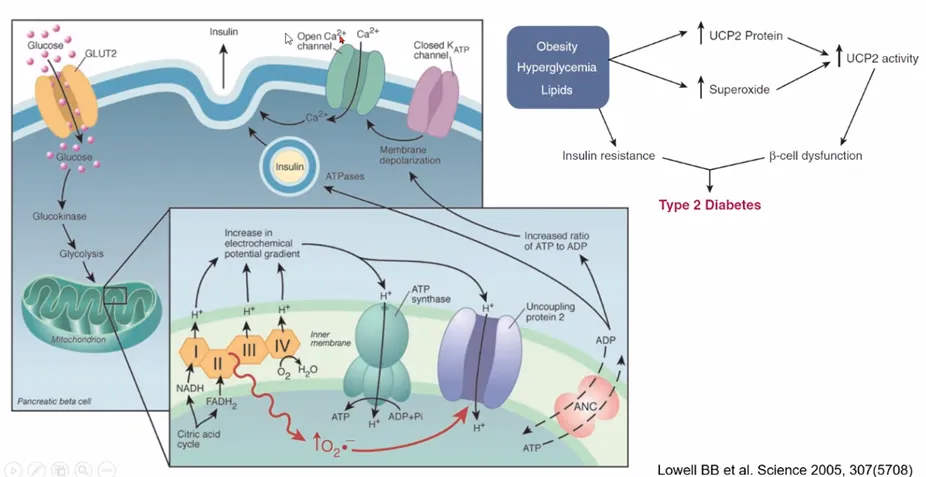
肥満や高血糖はUCP2蛋白やスーパーオキシドを増加させると言われる。
UCP(uncoupling protein:脱共役蛋白)は、ミトコンドリアでの電子伝達系とATP合成が膜でのプロトン濃度勾配によって密に共役しているのに対して、この共役を短絡的に解消する特殊なチャネルであり、これが活性化されると、酸化基質の化学エネルギーはATP合成に利用されずに、熱へと変換される。(ミトコンドリア共役蛋白質UCPファミリーとエネルギー消費・肥満より)
肥満状態等でなければ、ミトコンドリア内膜上ではプロトン勾配を利用するチャネルのみが動くけど、肥満状態になると内膜上にUCP2タンパクの発現が増え、H+の行き先が分散され、ATPへの変換効率(すなわちインスリン分泌能)が落ちるとされる。
上記リンクにあるようにUCP1は褐色脂肪細胞に存在して非運動での熱産生に寄与していることがわかっているが、UCP2については複数の臓器に存在しており、熱産生以外の作用については詳しくはわかっていない。
グルコースの輸送体
グルコース輸送体(GLUT)
は、哺乳動物の細胞膜に存在するタンパク質ファミリーで、細胞の中と外との間でのグルコースの受動的な輸送を担当します。GLUTは、インスリンの存在下であるいは筋肉の収縮のような刺激により細胞膜へと移動することで、細胞内へのグルコース取り込みを調節することができます。
いくつかの異なるGLUTのアイソフォームが知られており、それぞれ異なる組織や細胞での発現や役割を持っています。以下に、主要なGLUTのアイソフォームとその主な存在組織や機能について簡単に説明します:
- GLUT1: 主に赤血球、血液脳関門、胎児の組織に存在します。基本的なグルコース供給を担当しており、他の組織でも低レベルで発現していることがあります。
- GLUT2: 主に肝臓、膵臓のβ細胞、腎臓、小腸に存在します。肝臓でのグルコースの取り込みと放出、そして膵臓のβ細胞でのインスリン分泌の調節に関与しています。
- GLUT3: 主に脳に存在します。脳の高いエネルギー要求に応えるためのグルコース輸送を担当しています。
- GLUT4: 筋肉組織や脂肪組織に主に発現しています。インスリンに反応して細胞膜へと移動し、これによりインスリン刺激下でのグルコース取り込みが増加します。
- GLUT5: 主に小腸に存在し、フルクトースの輸送に特化しています。
以上のように、GLUTファミリーの各メンバーは、その発現する組織や細胞のエネルギー要求や機能に応じて特異的な役割を果たしています。
ナトリウム-グルコース共輸送体(SGLT)
SGLTは「Sodium-Glucose Linked Transporter(ナトリウム-グルコース共輸送体)」の略で、ナトリウムとグルコースを細胞内に同時に取り込むアクティブトランスポートのメカニズムを持つタンパク質ファミリーを指します。SGLTは、特に腎臓の尿細管や小腸の上皮細胞で発現しており、これらの組織でのグルコース再吸収に重要な役割を果たしています。
以下は、SGLTの主要なタイプとその特性についての説明です:
- SGLT1: 主に小腸の上皮細胞で発現しており、食事から取り込んだグルコースやガラクトースの吸収に関与しています。また、腎臓の一部でも発現しています。
- SGLT2: 腎臓の近位尿細管で主に発現しており、尿中に排泄されたグルコースの約90%を再吸収する役割を持っています。このため、SGLT2は糖尿病の治療の標的として注目されており、SGLT2阻害薬は尿中へのグルコース排泄を増加させて血糖を低下させる効果があります。
SGLTは、ナトリウムの濃度勾配を利用して、グルコースを細胞内に取り込むアクティブトランスポートを行います。この濃度勾配は、ナトリウム-カリウムポンプによって維持されています。SGLTを通じてのグルコースの再吸収は、体内でのグルコースの恒常性を保つために非常に重要です。
ATP供給の優先順位
- ATP-PCr系(筋肉内のみ。ATPの即時供給。約10秒持続。クレアチンリン酸のリン酸基をADPへ)
- 解糖系(好気的条件下)(中程度のエネルギー需要)
- グリコーゲン分解(短時間でのエネルギー供給。血糖値70以下。グルカゴン、アドレナリン分泌で促進、インスリンで抑制)
- 解糖系(嫌気的条件下)(酸素供給が不足する状況下)乳酸生成
- 脂肪の分解(脂肪酸のβ酸化(持続的なエネルギー供給)、糖新生(グリセロール→ジヒドロキシアセトンリン酸))
- タンパク質分解(長期間にわたるエネルギー供給の最終手段。糖原生アミノ酸またはケト原生アミノ酸として)
通常の血糖値の範囲内であれば解糖系が優先的に進行する。
血糖値が70を下回ってくると、グルカゴンやアドレナリン等によりグリコーゲンの分解が進み、グルコースが供給される。
嫌気的条件下では乳酸が蓄積していくとATPを生成できなくなる。乳酸の糖新生はATPの収支がマイナスなのでホメオスタシス目的のために過ぎない。
グリコーゲンが枯渇すると脂肪の分解が起こる。
脂肪の分解により生じた脂肪酸をβ酸化することで大量のアセチルCoAが生成する。生成したアセチルCoAを原料として肝臓でケトン体が合成され、骨格筋などの他組織へと移動した後アセチルCoAに戻されることでTCA回路→酸化的リン酸化でATPを産生する。
脂肪の分解で生じたグリセロールの方は肝臓でジヒドロキシアセトンリン酸に戻されてグルコースまで糖新生される。
通常は乳酸やグリセロールからの糖新生で血中グルコース濃度はある程度一定に保たれるが、それでも血糖値が維持できない場合、タンパク質分解によって糖原生アミノ酸を作り、糖原生アミノ酸を使ってグルコースを作り血糖値を維持する。
参考サイト:薬学部学生向け講義資料ダウンロード
- 糖質の構造と種類
- 脂質の種類
- タンパク質の種類
-
ビタミン
├ 脂溶性ビタミン
| ├ ビタミンA
| ├ ビタミンD
| ├ ビタミンE
| ├ ビタミンF
| └ ビタミンK
|
└ 水溶性ビタミン
├ ビタミンB1
├ ビタミンB2
├ ビタミンB6
├ ビタミンB12
├ ビタミンC
├ ビタミンM
├ ビタミンH
├ ビタミンP
├ ビタミンQ
├ ニコチン酸
└ パントテン酸
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


