筋肉の収縮とクレアチン
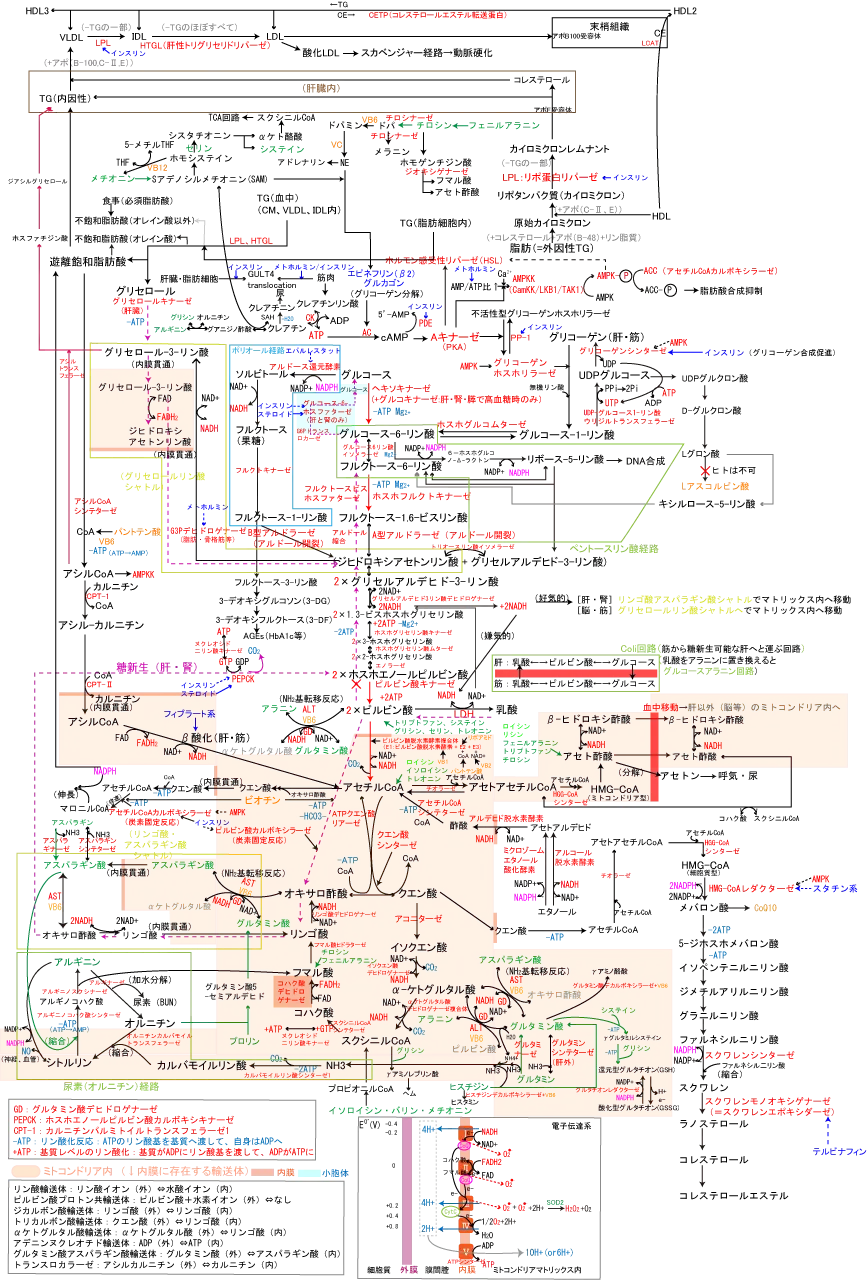
代謝全体マップは以下図参照。
筋肉の収縮と弛緩
筋肉は多数の筋繊維から成り立っていて、タンパク質は筋繊維の主要な構成成分の一つである。
筋肉にはタイプ1(遅筋)とタイプ2(速筋)があり、速筋の筋繊維は力強く、早く収縮する特性を持っている。速筋を鍛えるには高強度で短時間のトレーニングや、重量を重くして低反復数のトレーニングが必要なのに対して、遅筋は低強度の長時間、高反復数の有酸素なトレーニングが適している。
筋繊維内にはサルコメアと呼ばれる単位構造が並んでおり、サルコメアの中には、中央部にミオシンフィラメント(太いフィラメント)があり、その両側にアクチンフィラメント(細いフィラメント)が配置されています。アクチンとミオシンは筋収縮の過程で中心的な役割を果たすタンパク質です。
筋肉を太くするにはミオシンとアクチンの両方のフィラメントを増加させることが重要である。
ミオシンフィラメントは、主にミオシン分子から構成されています。ミオシン分子は「尾部」と2つの「頭部」から成る棒状のタンパク質で、複数のミオシン分子が集まってミオシンフィラメントを形成します。
「頭部」は、ミオシン分子の一方の端に存在し、この頭部がアクチンフィラメントに結合して滑り動く役割を果たします。ミオシンの頭部は、ATPをエネルギー源として使用し、アクチンとの相互作用を通じて筋収縮を行います。
具体的なメカニズムは、
- 非収縮状態: リラックスした筋肉(非収縮状態)では、ミオシンの頭部はアクチンに結合していません。この時、トロポミオシンというタンパク質がアクチン上のミオシン結合部位を覆っており、ミオシンとアクチンの結合を阻止しています。
- 収縮開始: 筋収縮のシグナルが伝達されると、カルシウムイオンが放出され、これがトロポニンというタンパク質に結合します。トロポニンの形状が変わり、トロポミオシンが移動して、アクチンのミオシン結合部位が露出します。
- ミオシンとアクチンの結合: 露出した結合部位にミオシンの頭部が結合します。この時点で、ミオシンの頭部はADPとリン酸を結合している状態です。
- パワーストローク: ミオシンの頭部がアクチンに結合した後、形状変化を起こし(これをパワーストロークと呼びます)、アクチンフィラメントを引き寄せます。この時、結合していたADPとリン酸が放出されます。
- ATPの結合と分解: 新しいATPがミオシンの頭部に結合すると、ミオシンはアクチンから解離します。その後、ミオシンの頭部でATPがADPとリン酸に加水分解(ATP+H2O→ADP+Pi(無機リン酸)+エネルギー)されると、再びミオシンの頭部はアクチンに結合できる状態に戻ります。
この過程が繰り返されることで、筋肉は収縮します。エネルギー供給としてのATPの役割は、ミオシンの頭部とアクチンの結合・解離を可能にすること、およびパワーストロークを駆動することにあります。
この反応を個別に見るとATPを使用して筋収縮を引き起こしているという感じがしないが、ATPがミオシン頭部に結合している状態(ミオシンとアクチンが解離している状態)をスタートにすれば、加水分解が起こってそのエネルギーを用いて形状変化とアクチンの引き寄せを行っていると解釈することが可能である。
クレアチン
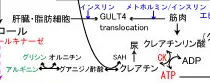
クレアチンは、アルギニンとグリシンから作られるグアニジノ酢酸がメチオニンから作られるSアデノシルメチオニン(SAM)からメチル基を受け取って合成される。
筋肉にはクレアチンキナーゼ(CK)が豊富に存在し、ATPが過剰な時は、クレアチンはCKとATPを使用してクレアチンリン酸を作り筋肉内に蓄える。
一方、ATPが必要な時は、クレアチニンリン酸のリン酸基をADPに渡してATPを生成する。この反応は酵素を必要とせず、他のどの反応よりも優先されるが、筋肉内に保存されているクレアチンリン酸の量が枯渇するまでの数秒程度しか使えない。
参考サイト:薬学部学生向け講義資料ダウンロード
- 糖
- 脂質
- タンパク質
-
ビタミン
├ 脂溶性ビタミン
| ├ ビタミンA
| ├ ビタミンD
| ├ ビタミンE
| ├ ビタミンF
| └ ビタミンK
|
└ 水溶性ビタミン
├ ビタミンB1
├ ビタミンB2
├ ビタミンB6
├ ビタミンB12
├ ビタミンC
├ ビタミンM
├ ビタミンH
├ ビタミンP
├ ビタミンQ
├ ニコチン酸
└ パントテン酸
コメントor補足情報orご指摘あればをお願いします。
- << 前のページ
- 次のページ >>


